题目内容
11.下列装置能达到相应实验目的是( )| A. |  | B. | 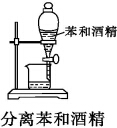 | C. |  | D. | 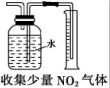 |
分析 A.盐酸也能和硅酸钠反应生成难溶性硅酸;
B.互不相溶的液体采用分液方法分离;
C.过氧化钠和水反应生成氧气;
D.用排水法收集的气体不能易溶于水也不能和水反应.
解答 解:A.浓盐酸具有挥发性,所以生成的二氧化碳中含有HCl,盐酸也能和硅酸钠反应生成难溶性硅酸,从而干扰实验,可以将浓盐酸换为稀硫酸,故A错误;
B.互不相溶的液体采用分液方法分离,乙醇和苯互溶,不能采用分液方法分离,应该采用蒸馏方法分离,故B错误;
C.过氧化钠和水反应生成氧气,可以制取少量氧气,故C正确;
D.用排水法收集的气体不能易溶于水也不能和水反应,二氧化氮和水反应生成硝酸和NO,所以不能采用排水法水解,应该采用排空气法收集,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及气体收集和制取、物质的分离和提纯、非金属性强弱判断等知识点,明确物质性质及实验原理是解本题关键,易错选项是A.

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
1.液氨溶解金钠属后成为蓝色的导电能力很强的溶液,其颜色被认为是电子的氨合e-(NH3)n引起的.若放置后,蓝色逐渐褪去,蒸发褪色后的溶液得到白色氨基钠(NaNH2),反应的化学方程式为:2Na+2NH3=NaNH2+H2↑,下列说法中不正确的是( )
| A. | 溶液褪色的速率与逸出氢气的速率成正比 | |
| B. | 液氨中有如下平衡:2NH3=NH4++NH2- | |
| C. | 液氨是一种非电解质,在水中才能电离 | |
| D. | 碱金属的液氨溶液是一种强还原剂 |
2.NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | NA个水分子在标准状况下的体积约为22.4L | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | H2SO4的摩尔质量就是NA个硫酸分子的总质量 | |
| D. | 在标准状况下,0.5NA个氯气分子所占的体积为11.2L |
19.某有机物有如下性质:①能和银氨溶液共热得到银镜;②加入碳酸氢钠无变化;③与含酚酞的氢氧化钠溶液共热,发现红色褪去.则该有机物可能是( )
| A. | 乙醇 | B. | 乙醛 | C. | 乙酸 | D. | 甲酸乙酯 |
16.下列物质属于氧化物的是( )
| A. | H2,O3 | B. | H2SO3,H2CO3 | C. | SO2,NO | D. | Na2SO3,KClO3 |
3.Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3+6OH--6e-=N2+6H2O.
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚.一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).
(4)容器I中的反应达到平衡时所需的时间大于(填“大于”“小于”或等于)容器II中的.
(5)a=0.16
(6)下列说法中能说明该反应达到平衡状态的是BD.(填字母)
A.容器中压强不变 B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变 D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
则下列m与n的关系中,正确的是A(填字母).
A.n>2m B.m>2n C.2m>n D.m>3n.
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3+6OH--6e-=N2+6H2O.
Ⅱ.甲醇是一种重要的有机化工原料,可用于制取甲醚.一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | a | b |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(5)a=0.16
(6)下列说法中能说明该反应达到平衡状态的是BD.(填字母)
A.容器中压强不变 B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变 D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-m kJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-n kJ•mol-1
则下列m与n的关系中,正确的是A(填字母).
A.n>2m B.m>2n C.2m>n D.m>3n.
4.下列说法正确的是( )
| A. | 溶液是呈电中性的,而胶体是可以带电的 | |
| B. | 向沸水中加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色时即得到Fe(OH)3胶体 | |
| C. | 清晨,阳光透过树叶间的缝隙可以产生丁达尔效应,说明空气是一种胶体 | |
| D. | 常用于区分溶液和胶体的方法是利用丁达尔效应,属于化学方法 |
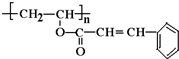
 ;
; 、
、 ,且苯环上有两个对位取代基的结构简式是
,且苯环上有两个对位取代基的结构简式是 .
. 在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示:
在500℃下,向某恒容密闭容器中投入amolA2和bmolB2发生可逆反应A2(g)+B2(g)?2AB(g),△H>0,AB的物质的量与时间关系如图所示: