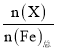题目内容
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )
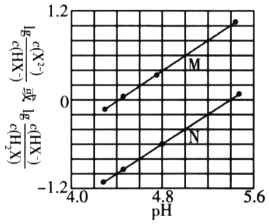
A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
【答案】C
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),酸性条件下,则pH相同时![]() >
> ![]() ,由图象可知N为lg
,由图象可知N为lg![]() 的变化曲线,M为lg
的变化曲线,M为lg![]() 的变化曲线,当lg
的变化曲线,当lg![]() 或lg
或lg![]() = 0时,说明
= 0时,说明![]() 或
或 ![]() =1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
=1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
A. 由以上分析可知曲线N表示pH与lg![]() 的变化关系,曲线M表示pH与lg
的变化关系,曲线M表示pH与lg![]() 的变化曲线,故A项错误;
的变化曲线,故A项错误;
B. 由图象可知,lg![]() = 0时,即
= 0时,即![]() =1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
=1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
C. 由图象可知当混合溶液呈中性时,lg![]() > 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
> 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
D. lg![]() = 0时,
= 0时,![]() =1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
=1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】I.有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)D﹣的结构示意图是___。
(2)C元素的气态氢化物的化学式为:___;其检验方法:___。
(3)B元素在周期表中的位置___;离子半径:B___A(填“大于”或“小于”)。
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___,与D的氢化物的水化物反应的离子方程式为___。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)NO的平衡浓度c/span>(NO)=___。
(2)图中表示NO2变化的曲线是___,用O2表示0~2s内该反应的平均速率υ=___。
(3)能说明该反应已达到平衡状态的是___。
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变