题目内容
【题目】常温下,向![]() 溶液中,不断通入HCl气体
溶液中,不断通入HCl气体![]() 忽略溶液体积变化
忽略溶液体积变化![]() ,得到
,得到![]() 和
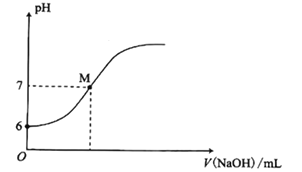
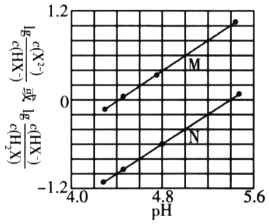
和![]() 与pH的变化关系如图所示,则下列说法不正确的是
与pH的变化关系如图所示,则下列说法不正确的是![]()
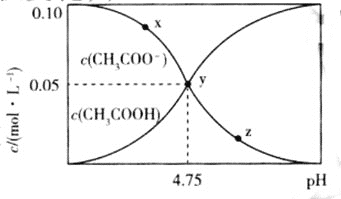
A.溶液中水的电离程度:![]()
B.在y点时,通入的HCl气体在标准状况下的体积为![]()
C.随着HCl的通入,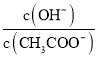 不断减小
不断减小
D.该温度下,![]() 的
的![]()
【答案】B
【解析】
醋酸钠溶液与氯化氢气体反应生成醋酸与氯化钠:![]() ,
,
A.溶液的pH越小,醋酸根离子的浓度越大,水的电离程度越大,所以![]() ,故A正确;
,故A正确;
B.y点是乙酸根浓度和乙酸的浓度相等,此时溶液呈酸性,说明电离程度大于水解程度,即乙酸的物质的量略大于乙酸钠的物质的量,所以在y点再通入的标况下的HCl气体体积大于1.12L,故B错误;
C.随着HCl的加入,![]() 不断增大,则
不断增大,则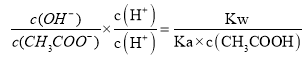 不断减小,故C正确;
不断减小,故C正确;
D.该温度下,醋酸的电离常数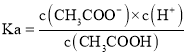 ,利用y点的数值计算可得:
,利用y点的数值计算可得:![]() ,故D正确。
,故D正确。
故选B。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________。
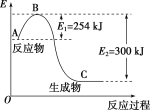
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及(1)的图中数据计算N—H键的键能为________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________。
【题目】某些化学问题可用相似的示意图来表示。下列说法不正确的是![]()
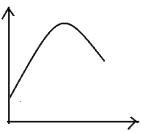
选项 | 横坐标 | 纵坐标 | 研究对象 |
A | 反应时间 | 溶液温度 | 足量镁条放在 |
B | 反应温度 | 反应速率 | 酶催化反应 |
C | 盐酸体积 | 沉淀质量 |
|
D | 反应过程 | 能量 |
|
A.AB.BC.CD.D