题目内容
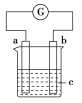
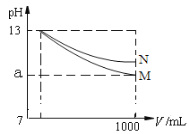
【题目】pH=13的两种碱溶液M、N各1mL,分别加水稀释到1000mL,其pH与溶液体积(V/mL)的关系如图所示,下列说法正确的是( )
A.M、N两种碱溶液的物质的量浓度一定相等
B.稀释后,M溶液的碱性比N溶液强
C.若10<a<13,则M、N都是弱碱
D.若a=10,则M是强碱,N不一定是弱碱
【答案】C
【解析】
碱溶液加水稀释,氢氧根离子浓度不断减小,pH不断减小,但弱碱存在电离平衡,加水稀释促进电离,氢氧根离子浓度减小的慢,故pH也减小的慢,所以N一定是弱碱,M碱性比N强。
A.由于碱性N比M弱,所以等pH的两碱溶液,N的物质的量浓度更大,故A错误;
B.稀释后,N溶液的pH>M溶液pH,因此稀释后,M溶液的碱性比N溶液弱,故B错误;
C.弱碱存在电离平衡,加水稀释促进电离,氢氧根离子浓度减小的慢,故pH也减小的慢,所以若10<a<13,则M、N中都存在电离平衡,都是弱碱,故C正确;
D.强碱在水溶液中完全电离,氢氧根离子物质的量不变,溶液稀释1000倍,pH则减小3个单位,故若a=10,则M是强碱,N是弱碱,故D错误;
故选C。

练习册系列答案
相关题目