题目内容
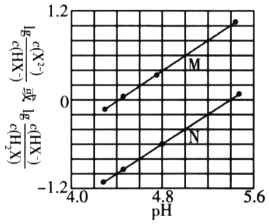
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=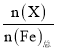 ]。下列说法正确的是( )
]。下列说法正确的是( )

A.K2FeO4、H2FeO4都属于强电解质
B.25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D.A、C两点对应溶液中水的电离程度相等
【答案】C
【解析】
A.溶液中存在H2FeO4,说明H2FeO4在溶液中存在电离平衡,则H2FeO4属于弱电解质,故A错误;
B.结合图象可知,c(H2FeO4)=c(H3FeO4+)时,溶液的pH<2,c(H+)>0.01mol/L,则H2FeO4+H+H3FeO4+的平衡常数K=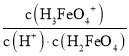 =
=![]() <
<![]() =100,即K<100,故B错误;
=100,即K<100,故B错误;
C.B点pH=4,δ(HFeO4-)=0.806,则δ(H2FeO4)≈0.194,由于溶液体积相同,则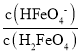 =
=![]() ≈4.15,则H2FeO4的第一步电离常数Ka1=
≈4.15,则H2FeO4的第一步电离常数Ka1=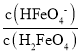 ×c(H+)=4.15×1×10-4=4.15×10-4,故C正确;
×c(H+)=4.15×1×10-4=4.15×10-4,故C正确;
D.FeO42-水解促进了水的电离,c(FeO42-)的浓度浓度越大,则水的电离程度越大,根据图象可知,水的电离程度:C>A,故D错误;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】某些化学问题可用相似的示意图来表示。下列说法不正确的是![]()
选项 | 横坐标 | 纵坐标 | 研究对象 |
A | 反应时间 | 溶液温度 | 足量镁条放在 |
B | 反应温度 | 反应速率 | 酶催化反应 |
C | 盐酸体积 | 沉淀质量 |
|
D | 反应过程 | 能量 |
|
A.AB.BC.CD.D
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢