题目内容
1.石蕊是一种弱酸,石蕊分子(HZ)及其酸根离子(Z-)在水溶液中具有完全不同的颜色.其中HZ的颜色是( )| A. | 红色 | B. | 紫色 | ||
| C. | 蓝色 | D. | 视溶液的酸碱性待定H2 |
分析 石蕊是一种弱酸,石蕊分子HZ在溶液中存在电离平衡:HZ?H++Z-,酸溶液中石蕊显示红色,碱溶液中石蕊试液显示蓝色,石蕊试液为紫色,然后结合氢离子、氢氧根离子对该电离平衡的影响进行判断.
解答 解:根据石蕊是一种弱酸可知,石蕊分子HZ在溶液中存在电离平衡:HZ?H++Z-,
酸溶液中滴入石蕊试液显示红色,酸溶液中氢离子浓度增大,则HZ的电离平衡向着逆向移动,HZ的浓度增大,溶液变成红色,则HZ为红色;
碱溶液中石蕊试液显示蓝色,碱溶液中氢离子浓度减小,Z-的浓度增大,则Z-的颜色应该为蓝色,
中性溶液中,存在的电离平衡使溶液显示紫色,
根据分析可知,HZ的颜色是红色,
故选A.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确氢离子、氢氧根离子对石蕊HZ的电离平衡的影响为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
11.短周期主族元素X、Z、Y、W的原子序数依次增大.其中X、Y同主族,Y的单质是一种良好的半导体材料,Z元素原子最外层电子数等于其电子层数,W是同周期中原子半径最小的元素.下列叙述正确的是( )
| A. | W-的离子半径大于Z3+的离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的稳定性比X的强 |
12.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| D. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
16.下列离子方程式中正确的是( )
| A. | 向碳酸钠溶液中加入足量的盐酸 CO32-+2H+═CO2↑+H2O | |
| B. | 单质铁和三氯化铁溶液反应生成氯化亚铁 Fe+Fe3+═2Fe2+ | |
| C. | 金属钠与水反应生成氢氧化钠和氢气Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铵晶体和石灰粉共热产生氨气 NH4++OH-═NH3↑+H2O |
6.对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是几种常见弱酸的电离平衡常数(25℃).
回答下列问题:
(1)当升高温度时,K值变大,向各弱酸溶液中滴加少量NaOH溶液,K值不变(以上选填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系在相同条件下K值越大,电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通到过量的碳酸钠溶液中Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
②在过量的氯水中滴入少量的碳酸钠溶液2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO.
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)当升高温度时,K值变大,向各弱酸溶液中滴加少量NaOH溶液,K值不变(以上选填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系在相同条件下K值越大,电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通到过量的碳酸钠溶液中Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
②在过量的氯水中滴入少量的碳酸钠溶液2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO.
13.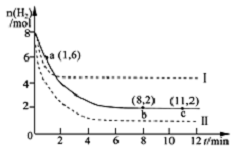 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2mol•L-1•min-1 | |
| B. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| C. | 曲线II对应的条件改变是降低压强 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<8/3 mol•L-1 |
10.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下22.4 L H2中含中子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 1molFe与足量O2或Cl2反应均失去3NA个电子 |
11.下列有机物中,一定条件下不能与H2发生反应的是( )
| A. | 苯 | B. | 乙醛 | C. | 乙酸 | D. | 油酸甘油酯 |

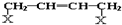
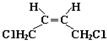

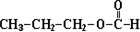 和
和 

 _
_