题目内容
【题目】第二代半导体材料——(Ⅲ-V)A族化合物的特殊性能使之成为科学家的研究热点之一。
(1) 基态镓原子的价电子轨道表示式为_____________。
(2) N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,N2O的空间构型为_________,NH4NO3中N的杂化方式为_________________,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH¥的键角大的原因__________________________。
(4)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有________________。
(5)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因_____________________。
(6)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值, 则磷化铝晶体的密度ρ=_________g/cm3。

【答案】  7 直线形 sp3 、sp2 CCl4(或SiF4等) N原子半径比P原子半径小,NH3分子中成键电子对间的距离较近,斥力更大。 Mg、Si、S 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低。 4 【答题空10】
7 直线形 sp3 、sp2 CCl4(或SiF4等) N原子半径比P原子半径小,NH3分子中成键电子对间的距离较近,斥力更大。 Mg、Si、S 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低。 4 【答题空10】![]() ×1030
×1030
【解析】(1) 镓与铝属于同一主族元素,位于第4周期,基态镓原子的价电子轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) N、P、As位于同一主族,基态氮原子的核外有7个电子,运动状态各不相同,已知N2O与CO2互为等电子体,等电子体的结构相似,已知CO2为直线形的分子,所以N2O的空间构型为直线形, NH4NO3中有2种N,其中铵根离子中N采用sp3杂化,硝酸根中的N采用sp2杂化,与PO43-互为等电子体的分子有CCl4、SiF4等,故答案为:7;直线形;sp3、 sp2;CCl4(或SiF4等);
(3)N原子半径比P原子半径小,NH3分子中成键电子对间的距离较近,斥力更大。使得NH3分子的键角大于PH3分子的键角,故答案为N原子半径比P原子半径小,NH3分子中成键电子对间的距离较近,斥力更大:;
(4)同一周期从左到右,第一电离能逐渐增大,但轨道全空或半充满状态时反常,在第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有Mg、Si、S,故答案为:Mg、Si、S;
(5)氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低,故答案为:氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低;
(6)根据结构示意图,每个P原子周围有4个铝原子形成正四面体结构,每个铝原子周围有4个P原子形成正四面体结构,A1原子的配位数为4,在晶胞中铝原子的个数为8×![]() +6×
+6×![]() =4,P原子的个数为4,化学式为AlP,两个铝原子之间的最近距离为d pm=d ×10-10cm,则晶胞的边长为
=4,P原子的个数为4,化学式为AlP,两个铝原子之间的最近距离为d pm=d ×10-10cm,则晶胞的边长为![]() d ×10-10cm,则磷化铝晶体的密度ρ=
d ×10-10cm,则磷化铝晶体的密度ρ=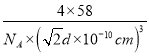 =
=![]() ×1030 g/cm3,故答案为:4;
×1030 g/cm3,故答案为:4; ![]() ×1030。
×1030。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
C | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
D | 向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液 | 产生白色沉淀 | 试样已氧化变质 |
A. A B. B C. C D. D



