题目内容
【题目】白炭黑(SiO2·nH2O)广泛用于硅橡胶、塑料、油漆涂料等,制备白炭黑的方法主要有两种。
(l)向硅酸钠溶液中通人热的HCl气体来制取白炭黑。
① 氯化氢的电子式为________。常温下Na2SiO3溶液的pH_______(填“>”“<”或“=” ) 7。
② 用化学方程式表示该制备原理:____________。
(2)以红土镍矿(含SiO2、MgO、Fe2O3、NiO等)为原料制取白炭黑,其工艺流程如图所示。
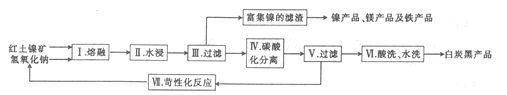
① 步骤1熔融反应器适宜的材质是_________(填“陶瓷”“玻璃”或“不锈钢”)。
② 步骤Ⅱ在稍低于100℃ 时进行水浸的目的是___________
③ 步骤Ⅳ通入过量二氧化碳并控制pH=8-9,碳酸化时发生反应的离子方程式为_____________
④ 向步骤V过滤得到的滤液中加人石灰乳,发生苛性化反应,会重新生成Na0H,该反应的化学方程式为____________。
⑤ 步骤Ⅵ酸洗后再进行水洗,某同学为加快洗涤速率,将水洗换为用无水酒精洗涤,该同学的操作___________(填“正确”或“不正确”)
【答案】 ![]() > 2HCl+Na2SiO3+(n-1)H2O=SiO2·nH2O↓+2NaCl 不锈钢 加快浸取速率 SiO32-+2CO2+(n+1)H2O=SiO2·nH2O↓+2HCO32- NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O 不正确
> 2HCl+Na2SiO3+(n-1)H2O=SiO2·nH2O↓+2NaCl 不锈钢 加快浸取速率 SiO32-+2CO2+(n+1)H2O=SiO2·nH2O↓+2HCO32- NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O 不正确
【解析】(l)① 氯化氢是共价化合物,其电子式为![]() ;硅酸是弱酸,SiO32-在溶液中要水解,则常温下Na2SiO3溶液的pH> 7,显碱性;
;硅酸是弱酸,SiO32-在溶液中要水解,则常温下Na2SiO3溶液的pH> 7,显碱性;
② 向硅酸钠溶液中通人热的HCl气体得SiO2·nH2O和NaCl,根据原子守恒配平得反应化学方程式为2HCl+Na2SiO3+(n-1)H2O=SiO2·nH2O↓+2NaCl;
(2)① 高温下NaOH可以和二氧化硅反应生成硅酸钠,则步骤1熔融反应器适宜的材质不能是陶瓷或玻璃,应选择不锈钢;
② 升高温度可以加快反应速率,步骤Ⅱ在稍低于100℃ 时进行水浸的目的是加快浸取速率;
③ 根据强酸制弱酸的原理,步骤Ⅳ通入过量二氧化碳并控制pH=8-9,可生成碳酸氢钠和SiO2·nH2O,根据电荷守恒及原子守恒,可得碳酸化时发生反应的离子方程式SiO32-+2CO2+(n+1)H2O=SiO2·nH2O↓+2HCO32-;
④向步骤V过滤得到的滤液中含有碳酸氢钠,加人石灰乳,会重新生成Na0H和碳酸钙沉淀,发生反应的化学方程式为NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O;
⑤ 酸化后生成的SiO2·nH2O表面有附着的碳酸氢钠溶液,用无水酒精洗涤无法除去碳酸氢钠,得到的产品不纯,故此操作不正确。

 华东师大版一课一练系列答案
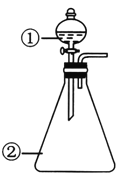
华东师大版一课一练系列答案【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象和结论合理的是
选项 | ①中物质 | ②中的物质 | 预测②中的现象和结论 |
|
A | 浓盐酸 | 二氧化锰 | 立即产生大量黄绿色气体,证明 HC1具有还原性和酸性 | |
B | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色,证明草酸具有还原性 | |
C | 硫酸铝饱和溶液 | 碳酸钠饱和溶液 | 立即产生大量气泡,证明两者相互促进水解 | |
D | 蒸馏水 | 过氧化钠粉末 | 立即产生大量气泡,滴加酚酞溶液后变红,说明过氧化钠是碱性氧化物 |
A. A B. B C. C D. D
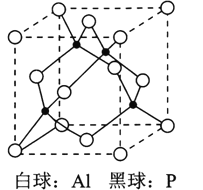
【题目】第二代半导体材料——(Ⅲ-V)A族化合物的特殊性能使之成为科学家的研究热点之一。
(1) 基态镓原子的价电子轨道表示式为_____________。
(2) N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,N2O的空间构型为_________,NH4NO3中N的杂化方式为_________________,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)已知NH3分子的键角约为107°,而PH3分子的键角约为94°,试用价层电子对互斥理论解释NH3的键角比PH¥的键角大的原因__________________________。
(4)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有________________。
(5)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因_____________________。
(6)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值, 则磷化铝晶体的密度ρ=_________g/cm3。