题目内容
1.有A、B、C、D、E五种短周期元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小.(1)A2B和A2D的沸点较高者是H2O(填化学式),其原因是H2O分子间存在氢键,而H2S分子间不存在氢键.
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有σ键和π键.
(3)E的基态原子电子排布式为1s22s22p63s23p5 .
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,结合原子序数可知,B一定处于第二周期、D处于第三周期,而C的原子序数大于B,则B、C一定不能处于同周期,故C处于第三周期,E原子序数大于D,E在同周期元素中原子半径最小,所以E是Cl元素;B、D的质子数之和最大为8+16=24,则A、C的质子数之和最大为12,由于C处于第三周期,故A为H、C为Na,则B为O、D为S,据此解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,结合原子序数可知,B一定处于第二周期、D处于第三周期,而C的原子序数大于B,则B、C一定不能处于同周期,故C处于第三周期,E原子序数大于D,E在同周期元素中原子半径最小,所以E是Cl元素;B、D的质子数之和最大为8+16=24,则A、C的质子数之和最大为12,由于C处于第三周期,故A为H、C为Na,则B为O、D为S.
(1)H2O分子间存在氢键,而H2S分子间不存在氢键,故H2O的沸点比H2S高,故答案为:H2O;H2O分子间存在氢键,而H2S分子间不存在氢键;
(2)O元素形成的双原子分子的结构式为O=O,从轨道重叠的角度来看共价键的类型有头对头的σ键和肩并肩的π键,故答案为:σ键和π键;
(3)E是Cl元素,其原子核外有17个电子,根据构造原理知,Cl原子的电子排布式为1s22s22p63s23p5,故答案为:1s22s22p63s23p5 .
点评 本题考查结构性质位置关系应用,推断元素是解题关键,较好的考查学生的分析推理能力,难度中等.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
13.下列有关化学用语使用正确的是( )
| A. | CO2的电子式: | |
| B. | 氟化氢的形成过程: | |
| C. | 表示甲烷分子和四氯化碳分子的比例模型: | |
| D. | 次氯酸的结构式:H-O-Cl |
10.下列叙述正确的是( )
| A. | Li在氧气中燃烧主要生成Li2O | |
| B. | 卤族元素单质X2(X:代表F、Cl、Br、I)均可以与水反应生成HX | |
| C. | 将SO2通入次氯酸钙溶液可能得到次氯酸 | |
| D. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
11.下列元素在自然界中以化合态存在的是( )
①Na ②Cl ③Al ④Fe.
①Na ②Cl ③Al ④Fe.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
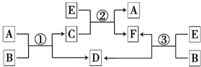 A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.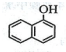 )的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种.
)的同分异构体,其分子中有两个官能团,能发生银镜反应,能被酸性KMnO4溶液氧化成G( C2H4O2)和芳香化合物H(C8H6O4),G和H与碳酸氢钠溶液反应均能放出CO2气体,H芳环上的一硝化产物只有一种. ;
; +Cu2O↓+2H2O;
+Cu2O↓+2H2O; +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O; 50mL0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: .
.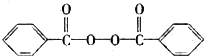
 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式: ;
;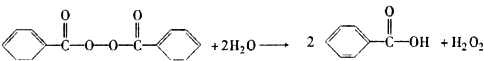
 ,属于酚类结构的同分异构体有3种.
,属于酚类结构的同分异构体有3种.