题目内容
18.固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4、NaNO3中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下: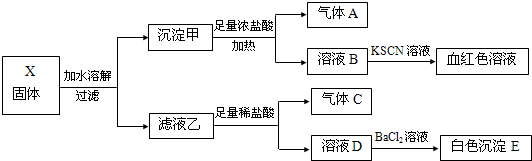
根据上述实验,下列说法正确的是( )
| A. | 固体X中一定含有Fe2O3 | |
| B. | 沉淀E可能含有BaSO3 | |
| C. | 气体A、C一定均为纯净物 | |
| D. | 固体X可能出现含有K2SO3、K2CO3而不含Na2SO4的情况 |
分析 气体A应为氯气,则应含有MnO2,溶液B与KSCN溶液生成血红色溶液,则说明B溶液中一定含有铁离子,即固体中一定含有FeO和Fe2O3中的至少一种,由于有氯气的存在,不能确定一定是Fe2O3,滤液乙于足量稀盐酸反应生成气体C,气体C可以是二氧化碳或者二氧化硫,溶液D加入氯化钡有白色沉淀,此沉淀一定为硫酸钡,但是此前若固体中存在NaNO3,在足量的稀盐酸中可以把亚硫酸根氧化生成硫酸根,以此解答该题即可.
解答 解:固体X加水溶解,固体加入足量的浓盐酸加热生成气体,该气体A应为氯气,则应含有MnO2,溶液B与KSCN溶液生成血红色溶液,则说明B溶液中一定含有铁离子,即固体中一定含有FeO和Fe2O3中的至少一种,由于有氯气的存在,不能确定一定是Fe2O3,滤液乙于足量稀盐酸反应生成气体C,气体C可以是二氧化碳或者二氧化硫,溶液D加入氯化钡有白色沉淀,此沉淀一定为硫酸钡,但是此前若固体中存在NaNO3,在足量的稀盐酸中可以把亚硫酸根氧化生成硫酸根,故固体中可能不存在Na2SO4,
A、依据分析可知,固体X中不一定含有Fe2O3,可能存在的是FeO,因为Fe2+可被氯气氧化生成Fe3+,故A错误;
B、由于乙到D加入的是足量的稀盐酸,故沉淀E不可能含有BaSO3,故B错误;
C、由分析可知:气体C可以是二氧化碳、二氧化硫或者二者的混合气体,故C错误;
D、由分析可知:固体X可能出现含有K2SO3、K2CO3而不含Na2SO4的情况,故D正确,故选D.
点评 本题考查物质的检验和鉴别的实验方案的设计,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
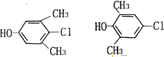
3.体育竞技中服用兴奋剂既有失公平,也破坏了体育道德,以下是其中检测出的两种兴奋剂的结构:
关于它们的说法中正确的是( )

关于它们的说法中正确的是( )
| A. | Y遇到氯化铁溶液时显紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3个手性碳原子 | |
| C. | 1mol X与足量NaOH溶液反应,最多可消耗3mol NaOH | |
| D. | 1个Y分子中最多有8个原子共面 |
9.下列说法正确的是( )
| A. | 若某温度下,0.2 mol/L的醋酸与0.09 mol/L的氢氧化钡等体积混合后呈中性(不考虑混合后溶液体积的变化),则可算出该温度下醋酸的电离常数 K=9×10-7 mol/L | |
| B. | 若某温度下氯化银的Ksp=10-10mol2/L2,则100 mL0.2 mol/L的氯化钠溶液与0.18 mol/L硝酸银溶液等体积混合后(不考虑混合后溶液体积的变化),溶液中c(Ag+)为10-8 mol/L | |
| C. | 若某温度下1 L密闭容器中反应HCHO(g)十H2(g)?CH3OH(g)达到平衡后甲醛的转化率为50%,则该温度下该反应的平衡常数是2(mol/L)-1 | |
| D. | 若向氢氧化钙的饱和溶液中加人氢氧化钠溶液,则会有固体析出 |
13.在某恒温密闭容器中,投入一定量的A发生可逆反应 A(s)?B(g)+C(g)△H=-QkJ.mol-1达到平衡.缩小容器体积,重新达到平衡时.以下分析不正确的是( )
| A. | C(g)的浓度与缩小体积前的平衡浓度相等 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 若保持体积不变,向平衡体系中加入少量的A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 molC,达到平衡时吸收热量Q kJ |
3.现有三组混合物:①水和苯 ②汽油和柴油 ③碘和氯化钠单质溶液,正确的分离方法依次是( )
| A. | 萃取,蒸馏,分液 | B. | 分液,萃取,蒸馏 | C. | 蒸馏,萃取,分液 | D. | 分液,蒸馏,萃取 |
10.下列措施能减慢化学反应速率的是( )
| A. | 双氧水分解时加入二氧化锰 | B. | 将块状药品研细后在进行反应 | ||
| C. | 用较浓的盐酸代替稀盐酸与锌反应 | D. | 将易腐败的食物储存在冰箱里 |
7.在研究有机历程时,常用816O作为示踪原子.816O的原子核内中子数是( )
| A. | 8 | B. | 18 | C. | 10 | D. | 28 |

 (写两种)
(写两种) 的化学方程式
的化学方程式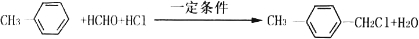 ,
, CH3COOCH3+H2O.
CH3COOCH3+H2O.