题目内容
锌-空气电池可能成为未来的理想动力源,该电池的电解质溶液可以是酸性或碱性.在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2═2Na2ZnO2+2H2O.下列有关锌-空气电池说法正确的是( )
| A、碱性电解质溶液中正极反应式为:4OH--4e-═O2↑+2H2O |
| B、碱性或酸性电解质溶液中,该电池正极反应式相同 |
| C、该电池工作时,Na+移向负极 |
| D、每生成1mol ZnO22-转移电子数为2NA |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池反应式知,锌作负极,负极上电极反应式为:Zn+40H--2e-═ZnO22-+2H20,正极上通入空气,其电极反应式为O2+2H2O+4e-=4OH-,原电池放电时,阳离子向正极移动,再结合ZnO22-和转移电子之间关系计算.
解答:
解:A.碱性电解质溶液中,正极上电极反应式为O2+2H2O+4e-=4OH-,故A错误;
B.酸性条件下,负极反应式为Zn-2e-=Zn2+、正极反应为O2+4e-+4H+=2H2O,与碱性条件下电极反应式不同,故B错误;
C.放电时,钠离子向正极移动,故C错误;
D.每生成1mol ZnO22-转移电子数=1mol×2×NA/mol=2 NA,故D正确;
故选D.
B.酸性条件下,负极反应式为Zn-2e-=Zn2+、正极反应为O2+4e-+4H+=2H2O,与碱性条件下电极反应式不同,故B错误;
C.放电时,钠离子向正极移动,故C错误;
D.每生成1mol ZnO22-转移电子数=1mol×2×NA/mol=2 NA,故D正确;
故选D.
点评:本题考查了原电池原理,知道离子移动方向、各个物理量之间的关系等知识点即可解答,难点是电极反应式书写,电解质溶液影响电极反应式书写,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
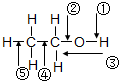 乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明不正确的是( )
乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明不正确的是( )| A、和金属钠反应时,键①断裂 |
| B、和浓硫酸共热至170℃时,键②和⑤断裂 |
| C、乙醇完全燃烧时,断裂键①② |
| D、在铜催化下和氧气反应时,键①和③断裂 |
应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质.下列预测中不正确的是
( )
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体.
( )
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体.
| A、①②③④ | B、②④⑥ |
| C、①③⑤ | D、②④⑤ |
下列装置中(杯中均盛海水)铁腐蚀最快的是( )
A、 |
B、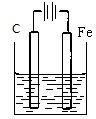 |
C、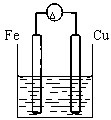 |
D、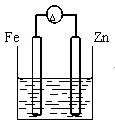 |
天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4=3N2+4H2O+2CO2,下列叙述错误的
是( )
是( )
| A、此反应中R的分子式为C2H8N2 |
| B、此反应是氧化还原反应,N2O4做氧化剂 |
| C、每生成67.2L N2转移电子数为8NA |
| D、此反应可在瞬间产生大量高温气体,推动火箭飞行 |
下列变化中不可能通过实验直接一步完成的是( )
| A、Al→Al[(OH)4]- |
| B、Cu→CuSO4 |
| C、Fe(OH)2→Fe(OH)3 |
| D、NH3→HNO3 |
下列有关氨的性质的叙述中正确的是( )
①氨不能在空气中燃烧②氨水呈碱性③氨气和酸相遇都能产生白色烟④在反应:NH3+H+═NH4+中氨失去电子被氧化⑤氨水中含氮微粒中最多的是NH4+.
①氨不能在空气中燃烧②氨水呈碱性③氨气和酸相遇都能产生白色烟④在反应:NH3+H+═NH4+中氨失去电子被氧化⑤氨水中含氮微粒中最多的是NH4+.
| A、①② | B、③⑤ | C、①⑤ | D、②⑤ |
下列关于电解质溶液的叙述正确的是( )
| A、室温下,pH=3的氢氟酸加水稀释后,电离常数Ka(HF)和pH均减小 | ||
| B、室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | ||
C、向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中
| ||
| D、室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
常温下,对于①0.1mol/L CH3COOH溶液 ②pH=1HCl溶液 ③pH=13的NaOH溶液 ④0.1mol/L CH3COONa溶液,下列说法正确的是( )
| A、①和②分别稀释100倍后的pH:②>① | ||
| B、水电离出的c(OH-):④>③>①>② | ||
C、①和③混合后溶液呈中性:
| ||
D、①和④混合后溶液呈酸性:
|