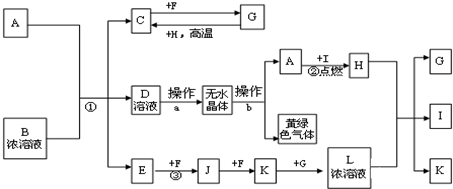
题目内容
常温下,对于①0.1mol/L CH3COOH溶液 ②pH=1HCl溶液 ③pH=13的NaOH溶液 ④0.1mol/L CH3COONa溶液,下列说法正确的是( )
| A、①和②分别稀释100倍后的pH:②>① | ||
| B、水电离出的c(OH-):④>③>①>② | ||
C、①和③混合后溶液呈中性:
| ||
D、①和④混合后溶液呈酸性:
|
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.①和②中酸的浓度相等,稀释促进弱电解质电离;
B.酸或碱都抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,则抑制水电离程度越大;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
B.酸或碱都抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,则抑制水电离程度越大;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答:
解:A.①和②中酸浓度相等,稀释促进醋酸电离,但醋酸不能完全电离,所以①和②分别稀释100倍后的pH:②<①,故A错误;
B.酸或碱都抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,则抑制水电离程度越大,②pH=1HCl溶液、③pH=13的NaOH溶液对水电离抑制程度相等,所以水电离出的c(OH-):③=②,故B错误;
C.混合溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(Na+),则
=1,故C错误;
D.混合溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒得c(CH3COO-)>c(Na+),所以
<1,故D正确;
故选D.
B.酸或碱都抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,则抑制水电离程度越大,②pH=1HCl溶液、③pH=13的NaOH溶液对水电离抑制程度相等,所以水电离出的c(OH-):③=②,故B错误;
C.混合溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(Na+),则
| c(Na+) |
| c(CH3COO-) |
D.混合溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒得c(CH3COO-)>c(Na+),所以
| c(Na+) |
| c(CH3COO-) |
故选D.
点评:本题考查了弱电解质的电离,根据弱电解质电离特点结合电解质溶液酸碱性、电荷守恒来分析解答,题目难度不大.

练习册系列答案
相关题目
锌-空气电池可能成为未来的理想动力源,该电池的电解质溶液可以是酸性或碱性.在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2═2Na2ZnO2+2H2O.下列有关锌-空气电池说法正确的是( )
| A、碱性电解质溶液中正极反应式为:4OH--4e-═O2↑+2H2O |
| B、碱性或酸性电解质溶液中,该电池正极反应式相同 |
| C、该电池工作时,Na+移向负极 |
| D、每生成1mol ZnO22-转移电子数为2NA |
下列有关实验原理、方法和结论都正确的是( )
| A、已知Cu2O+2H+═Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硫酸,说明红色固体是铜 |
| B、用蒸馏水、酚酞、BaCl2溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为Na2CO3)的纯度 |
| C、取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3 |
| D、用饱和碳酸钠溶液多次洗涤BaCO3,可除去BaCO3中少量的BaSO4,说明Ksp(BaCO3)<Ksp(BaSO4) |
关于物质的用途说法错误的是( )
| A、二氧化硅用于制造光导纤维 |
| B、聚氯乙烯塑料(PVC)可制成薄膜做食品包装材料 |
| C、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| D、铝合金用于制造门窗 |
下列微粒中,其核外电子数相同( )
①13Al3+② ③
③ ④F-.
④F-.
①13Al3+②
 ③
③ ④F-.
④F-.| A、①②③ | B、②③④ |
| C、①②④ | D、①③④ |
下列化学药品与其危险化学品图形标志不一致的一组是( )
A、 烧碱--1 |
B、 甲烷--2 |
C、 酒精--3 |
D、 白磷--4 |
下列说法不正确的是( )
| A、食盐是常用的调味剂和防腐剂 |
| B、淀粉在人体中最终水解为葡萄糖而被吸收 |
| C、多吃含钙丰富的豆腐可预防骨质疏松 |
| D、多吃富含维生素A的鱼肝油可预防坏血病 |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| D、碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ |