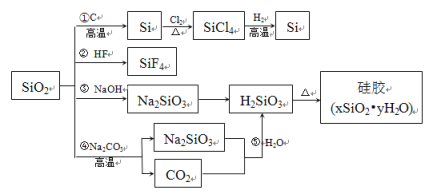
��Ŀ����
����Ŀ������������Ի���������������������Ⱦ��кܴ��Ӱ�졣�밴Ҫ��ش��������⣺
��1����֪��4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ��H1=-akJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ��H2=-bkJ/mol
H2O(l)=H2O(g) ��H3=+ckJ/mol
��NH3(g)��������ȼ�����ɵ�����Һ̬ˮ���Ȼ�ѧ����ʽΪ___��
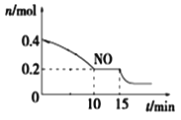
��2���ںϳɹ���ҵ�У������ڴ���Fe�ϵ������ֽⷴӦ��ܸߡ�����������˵����ķ�Ӧ���ʾ����˺ϳɰ��ķ�Ӧ���ʡ���ҵ�����У������¶�773K��ѹǿ3.0��105pa��ԭ����n(N2)��n(H2)=1��2.8�������˵��ԭ������N2����������___��
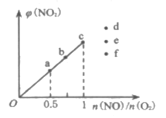
��3����֪��Ӧ2NO(g)+O2(g)![]() 2NO2(g)���ں��¡����ݵ��ܱ������а�һ���������������ʵ���һ����NO(g)��O2(g)��ƽ��ʱNO2���������[��(NO2)]��
2NO2(g)���ں��¡����ݵ��ܱ������а�һ���������������ʵ���һ����NO(g)��O2(g)��ƽ��ʱNO2���������[��(NO2)]��![]() �ı仯��ͼ��ʾ��NO��ת������С����___�㣨����a������b������c��)����
�ı仯��ͼ��ʾ��NO��ת������С����___�㣨����a������b������c��)����![]() =1.5ʱ���ﵽƽ��״̬ʱNO2���������������___�㣨����d������e������f��)��
=1.5ʱ���ﵽƽ��״̬ʱNO2���������������___�㣨����d������e������f��)��
��4�������еļ��쵰��(Mb)��O2�������MbO2����Ӧԭ���ɱ�ʾΪ��Mb(aq)+O2(g)![]() MbO2(aq)���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪ��K=
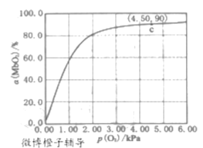
MbO2(aq)���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪ��K=![]() ��37��ﵽƽ��ʱ����ü��쵰�Ľ�϶�(a)��������ѹ[p(O2)]�Ĺ�ϵ��ͼ��ʾ[��=
��37��ﵽƽ��ʱ����ü��쵰�Ľ�϶�(a)��������ѹ[p(O2)]�Ĺ�ϵ��ͼ��ʾ[��=![]() ��100%]���о���������Ӧ����v��=k��c(Mb)p(O2)���淴Ӧ����v��=k��c(MbO2)������k����k���ֱ��ʾ�����淴Ӧ�����ʳ�������
��100%]���о���������Ӧ����v��=k��c(Mb)p(O2)���淴Ӧ����v��=k��c(MbO2)������k����k���ֱ��ʾ�����淴Ӧ�����ʳ�������
����(MbO2)������p(O2)������������������䣬ԭ����___��
����д��ƽ�ⳣ��K�����ʳ���k����k��֮��Ĺ�ϵʽK=___(�ú���k����k����ʽ�ӱ�ʾ)
�������ͼ��c��ʱ��������Ӧ��ƽ�ⳣ��K=___kPa-1��
.
���𰸡�4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ��H=-![]() (2a+3b+30c)kJ/mol N2�������ã�����N2���������������ת���ʣ�������Ӧ��������N2�������ͷֽ����ʾ����ģ�N2�ı�������Ӧ���ʼӿ� c d ǰһ����p(O2)����Ӧ���ʼӿ죬��(MbO2)��֮����μ��쵰��(Mb)����ȫ��ת��ΪMbO2
(2a+3b+30c)kJ/mol N2�������ã�����N2���������������ת���ʣ�������Ӧ��������N2�������ͷֽ����ʾ����ģ�N2�ı�������Ӧ���ʼӿ� c d ǰһ����p(O2)����Ӧ���ʼӿ죬��(MbO2)��֮����μ��쵰��(Mb)����ȫ��ת��ΪMbO2 ![]() 2
2
��������
��1�����ݸ�˹���ɣ�����֪�������Ȼ�ѧ����ʽ���ӣ��͵õ���Ӧ�ķ�Ӧ���Ȼ�ѧ����ʽ��
��2������N2�������������˷�Ӧ��Ũ�ȣ��ܼӿ췴Ӧ���ʣ����������ת���ʣ�
��3����![]() �ı�ֵԽ��NO��ת����ԽС��
�ı�ֵԽ��NO��ת����ԽС��![]() ��ֵԽ��NO2�������������
��ֵԽ��NO2�������������
��4���ٿ�ʼʱp(O2)����Ӧ���ʼӿ죬��(MbO2)��֮���������쵰��(Mb)����ȫ��ת��ΪMbO2����(MbO2)�������䣻
�ڸ��ݿ��淴Ӧ�ﵽƽ��״̬ʱ��V��=V�������ƽ�ⳣ������ʽ����K��k����k���Ĺ�ϵ��
�۽�P(O2)=4.5kPa�����쵰�Ľ�϶�(��)��90%��ͨ���������ƽ�ⳣ������ʽ�ɵ�K��
��1����4NH3(g)+6NO(g) =5N2(g)+6H2O(g) ��H1=��a kJ/mol
��4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) ��H2=��b kJ/mol
��H2O(l)=H2O(g) ��H3=+c kJ/mol
���ݸ�˹���ɣ���(����2+����3-����30)��![]() �������ɵ�4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ��H=-
�������ɵ�4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ��H=-![]() (2a+3b+30c)kJ/mol��
(2a+3b+30c)kJ/mol��
��2���ϳɰ���Ӧ�У�������Fe�ϵ������ֽⷴӦ��ܸߡ������������������ϳɰ��ķ�Ӧ���ʣ����ԭ�����е����������ɼӿ�ϳɰ��ķ�Ӧ���ʣ�ͬʱ�������ת���ʣ��ҵ������Բ��÷���Һ̬�����������õ������Դ�Ϊ��N2�������ã�����N2���������������ת���ʣ�������Ӧ��������N2�������ͷֽ����ʾ����ģ�N2�ı�������Ӧ���ʼӿ졣
��3��![]() �ı�ֵԽ������Ϊ������������������һ��������������NO��ת���ʷ�����С������NO��ת������С����c�㣻��
�ı�ֵԽ������Ϊ������������������һ��������������NO��ת���ʷ�����С������NO��ת������С����c�㣻��![]() =1.5ʱ������ͼʾ��
=1.5ʱ������ͼʾ��![]() ��ֵԽ��NO2����������������Դﵽƽ��״̬ʱ��NO2���������������d�㣻
��ֵԽ��NO2����������������Դﵽƽ��״̬ʱ��NO2���������������d�㣻
��4���ٿ�ʼʱp(O2)�����൱������ѹǿ����������Ũ�ȣ���Ӧ���ʼӿ죬��(MbO2)��֮���������쵰��(Mb)����ȫ��ת��ΪMbO2��p(O2)�����¼���û������MbO2����(MbO2)�������䣬��ԭ���ǣ�ǰһ����p(O2)����Ӧ���ʼӿ죬��(MbO2)��֮����μ��쵰��(Mb)����ȫ��ת��ΪMbO2��
�ڿ��淴Ӧ�ﵽƽ��״̬ʱ��V��=V������������=k����c(Mb)�� P(O2)������=k����c(MbO2)������k����c(Mb)�� P(O2)= k����c(MbO2)��![]() ������ӦMb(ag)+O2(g)
������ӦMb(ag)+O2(g)![]() MbO2(aq)��ƽ�ⳣ��K=
MbO2(aq)��ƽ�ⳣ��K=![]() ��
��
��c��ʱ��P(O2)=4.5�����쵰�Ľ�϶�(��)��90%�����迪ʼʱ��Mb 1mol/L��������=![]() ��100%�������ɵ�MbO20.9mol/L������ƽ�ⳣ������ʽ�пɵ�K=
��100%�������ɵ�MbO20.9mol/L������ƽ�ⳣ������ʽ�пɵ�K=![]() =2 kPa-1��
=2 kPa-1��