题目内容
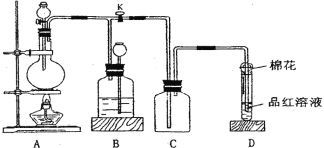
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
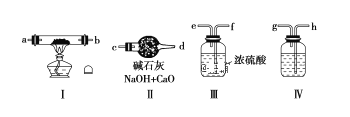
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:
空气→Ⅳ→____→___→____(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是____,其作用是_______。
(3)装置Ⅱ的作用是______。
(4)操作中通空气和加热的先后顺序为________。
(5)若去掉装置Ⅲ,装置Ⅰ中除反应生成Na2O2外,还可能发生的反应有______(写出两个化学方程式)。
【答案】Ⅲ Ⅰ Ⅱ NaOH溶液 吸收导入的空气中的CO2 吸收空气中的水蒸气和CO2,防止其进入Ⅰ装置,降低Na2O2纯度 先通空气,后加热 2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O==4NaOH+O2↑
【解析】
(1)金属钠和空气制备纯度较高的Na2O2,需要空气中的氧气和金属钠加热反应生成Na2O2,空气中的水蒸气和CO2,需要除去CO2后干燥;把空气通入IV中除去CO2,再通入浓硫酸中干燥,在装置I中加热生成Na2O2,装置II可防止空气中的CO2和水蒸气进入反应装置,据此分析作答;
(2)装置Ⅳ用于除去空气中的CO2,可以选择NaOH溶液;
(3)装置Ⅱ在整个实验的最后,用于防止空气中的CO2和水蒸气进入反应装置;
(4)实验时先通入足量的空气后再加热,可避免生成的Na2O2和CO2、水蒸气反应生成杂质;
(5)装置Ⅲ用于除去空气中的水蒸气,若去掉该装置,那么会发生金属钠与水的反应和过氧化钠与水的反应。
(1)由分析可知空气进入装置后先用氢氧化钠溶液除去CO2,再用浓硫酸干燥,最后金属钠与O2反应生成Na2O2,因此装置的连接顺序为:空气→Ⅳ→Ⅲ→Ⅰ→Ⅱ;
(2)装置Ⅳ用于除去空气中的CO2,一般选择NaOH溶液除去CO2;
(3)装置Ⅱ在整个实验的最后,用于防止空气中的CO2和水蒸气进入反应装置,因此装置Ⅱ的作用是吸收空气中的水蒸气和CO2,防止其进入Ⅰ装置,降低Na2O2纯度;
(4)为了避免生成的Na2O2和CO2、水蒸气反应生成杂质,应先通入足量的空气后再加热;
(5)装置Ⅲ用于除去空气中的水蒸气,若去掉该装置,那么会发生金属钠与水的反应和过氧化钠与水的反应,反应方程式分别为:2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑。

【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。

①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
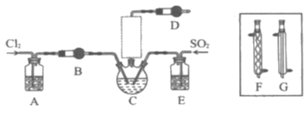
【题目】随着5G时代的到来,半导体材料将迎来快速发展,三氯化氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室利用PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验装置如图所示(气体的制备装置未画出)。
资料卡片:
物质 | 熔点/°C | 沸点/°C | 其他 |
PCl3 | -93.6 | 76.1 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl3 |
SOCl3 | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(1)该反应的化学方程式为___。
(2)A、B装置中的试剂分别是___、___。
(3)装置E的作用是___。
(4)反应装置的虚线框中未画出的仪器最好选用___(填“F”或“G”),理由是___。
(5)反应结束后,提纯POCl3的操作是___(填操作名称)。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000molL-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000molL-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是___。
②POCl3的质量分数为___。(保留一位小数)