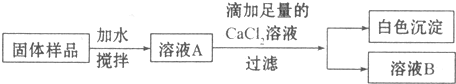
题目内容
7.下表是元素周期表的部分信息,表中所列的数字为原子序数,字母分别代表某一化学元素,请回答下列问题:
(1)地壳中含量最多的元素处于B 位置(用A、B、C、D、E表示),该元素处于元素周期表中的第二周期.其原子形成的稳定结构的微粒示意图为
 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.(2)已知在高温下,14号元素单质与另一种物质能通过化合反应制成光纤,该化学反应方程式是:O2+Si$\frac{\underline{\;高温\;}}{\;}$SiO2
(3)已知金属单质越易与水反应,金属的活动性就越强,实验发现:11号元素金属单质与冷水剧烈反应,l2号元素金属单质与热水缓慢反应,13号元素金属单质投入热水中无明显现象,则金属单质的活动性最强的是(用数字填写,后同)11,最弱的是13.
(4)17号元素与l2号元素结合形成的化合物化学式为MgCl2.
分析 题中为前20号元素,
(1)地壳中含量最多的元素为O元素,位于周期表第二周期ⅥA族,原子形成的稳定结构,则原子核外有2个电子层,最外层电子数为8;
(2)14号元素为Si,光纤的主要成分为SiO2;
(3)11号元素金属单质与冷水剧烈反应,l2号元素金属单质与热水缓慢反应,13号元素金属单质投入热水中无明显现象,说明11号元素最活泼,最弱的为13号元素;
(4)17号元素为Cl,12号元素为Mg,可形成氯化镁.
解答 解:(1)地壳中含量最多的元素为O元素,位于周期表第二周期ⅥA族,原子形成的稳定结构,则原子核外有2个电子层,最外层电子数为8,为阴离子,离子结构示意图为 ,该微粒的表示符号为O2-,
,该微粒的表示符号为O2-,
故答案为:B;二; ;O2-;
;O2-;
(2)14号元素为Si,光纤的主要成分为SiO2,反应的方程式为O2+Si$\frac{\underline{\;高温\;}}{\;}$SiO2,故答案为:O2+Si$\frac{\underline{\;高温\;}}{\;}$SiO2;
(3)11号元素金属单质与冷水剧烈反应,l2号元素金属单质与热水缓慢反应,13号元素金属单质投入热水中无明显现象,说明11号元素最活泼,最弱的为13号元素,
故答案为:11;l3;
(4)17号元素为Cl,12号元素为Mg,可形成氯化镁,化学式为MgCl2,故答案为:MgCl2.
点评 本题考查元素周期表与元素周期律综合应用,为高频考点,注意对元素周期律的理解掌握,有利于基础知识的巩固,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
15.下列实验操作正确的是( )
| A. |  称取食盐 | B. |  稀释浓硫酸 | C. |  检查气密性 | D. |  点燃酒精灯 |
2.在一个密闭的容器内有四种物质,高温下发生反应,一段时间后测得反应前后各物质的质量如下:
若a的相对分子质量为2n,d的相对分子质量为3n,则该反应的化学方程式中a与d的化学计量数比为( )
| a | b | c | d | |
| 反应前质量(g) | 8 | 10 | 1 | 25 |
| 反应后质量(g) | 未测 | 24 | 2 | 16 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
16.下列制取氢气的方法中,反应速率最小的是( )
| A. | 10℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| B. | 50℃时,粉末状锌与3 mol/L硫酸溶液反应 | |
| C. | 10℃时,块状锌与3 mol/L硫酸溶液反应 | |
| D. | 50℃时,块状锌与3 mol/L硫酸溶液反应 |
17.下列有关叙述错误的是( )
| A. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| B. | 高铁酸钾(K2FeO4)是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质 | |
| C. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| D. | 测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素原子示踪法等 |

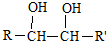 $\stackrel{HIO_{4}}{→}$RCHO+R′CHO
$\stackrel{HIO_{4}}{→}$RCHO+R′CHO . B→H的反应类型是取代反应.
. B→H的反应类型是取代反应.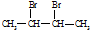 +2NaOH
+2NaOH CH3-C≡C-CH3+2NaBr+2H2O.
CH3-C≡C-CH3+2NaBr+2H2O.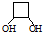 .
. 有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:
有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答: