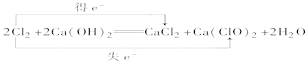题目内容
【题目】(1)Na2O2因能发生下列反应被用作补氧剂:2Na2O2+2CO2=2Na2CO3+O2,上述反应中,氧化剂与还原剂的物质的量之比为:___。
(2)某潜艇上有50人,每人每分钟消耗1.12LO2(标况),则一天需___molNa2O2。如用KO2作补氧剂,写出它和CO2反应的化学方程式_____。
①1kgNa2O2和1kgKO2分别和足量的CO2反应,生成O2的体积(同温同压)比为_____。
②等量的CO2分别和足量的Na2O2、KO2反应,生成O2的分子数(同温同压)比为____。
③你认为选用____作补氧剂更为合适,理由是_____。
【答案】1:1 7200mol 4KO2 +2CO2=2K2CO3+3O2 71:117 1:3 KO2 因为KO2产生的O2效率更高
【解析】
(1)在2Na2O2+2CO2=2Na2CO3+O2中只有Na2O2中O元素的化合价变化,Na2O2为氧化剂、还原剂;
(2)反应的相关方程式为2Na2O2+2CO2=2Na2CO3+O2,一天共需要氧气的体积为50×1.12L×60×24=80640L,物质的量为![]() =3600mol,结合反应的方程式计算;根据过氧化钠能和二氧化碳反应生成碳酸钠和氧气的反应来书写KO2与CO2的反应;
=3600mol,结合反应的方程式计算;根据过氧化钠能和二氧化碳反应生成碳酸钠和氧气的反应来书写KO2与CO2的反应;
①根据Na2O2与CO2的反应方程式以及KO2与CO2的反应方程式来计算;
②根据Na2O2与CO2的反应以及KO2与CO2的反应来计算;
③等质量的Na2O2和KO2分别和CO2反应生成的O2体积大小可以选择合适的供氧剂。
(1)在2Na2O2+2CO2=2Na2CO3+O2中只有Na2O2中O元素的化合价变化,为氧化剂、还原剂,由反应及原子守恒可知,氧化剂与还原剂的物质的量之比为1:1;
(2)一天共需要氧气的体积为50×1.12L×60×24=80640L,物质的量为![]() =3600mol,则:
=3600mol,则:
2Na2O2+2CO2=2Na2CO3+O2
2mol 1mol
x 3600mol
x=7200mol
过氧化钠能和二氧化碳反应生成碳酸钠和氧气,用超氧化钾(KO2)代替Na2O2也可起到同样的作用,所以超氧化钾(KO2)也能和二氧化碳反应生成碳酸钾和氧气,反应方程式为4KO2+2CO2=2K2CO3+3O2;
①根据化学方程式2Na2O2+2CO2=2Na2CO3+O2、4KO2+2CO2=2K2CO3+3O2
则2Na2O2~O2,4KO2~3O2,lkgNa2O2和lkgKO2分别和CO2反应,生成的O2体积比(同温同压下)等于物质的量之比,即 :
: ×3=71:117;
×3=71:117;
②根据化学方程式2Na2O2+2CO2=2Na2CO3+O2、4KO2+2CO2=2K2CO3+3O2
则2Na2O2~2CO2~O2,4KO2~2CO2~3O2
假设均为1mol的CO2分别和Na2O2、KO2反应,生成的O2分子数比等于物质的量之比,即为:![]() :
:![]() =1:3;
=1:3;
③根据第(2)小题的答案可以得出:等质量的KO2与Na2O2与足量CO2反应,前者生成的O2更多,即KO2产生的O2效率更高,所以用KO2作补氧剂更为合适。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案