题目内容
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
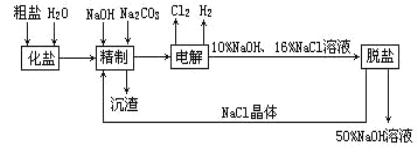
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为_______;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是______
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为______、_______
(4)电解饱和食盐水的总反应化学方程式为_________
【答案】2Cl--2e-==Cl2 升高 c Mg2++2OH-=Mg(OH)2↓ Ca2++CO32- ==CaCO3 2NaCl +2H2O==2NaOH+H2↑+Cl2↑
【解析】
从电解池基本原理分析其电极反应及pH变化,除杂过程将杂质转化为沉淀即可。
(1)与电源正极相连的是阳极,发生氧化反应,即氯离子被氧化生成氯气,其化学方程式为2Cl――2e-=Cl2↑;与电源负极相连的电极为阴极,氢离子发生还原反应,水的电离平衡遭受破坏,水进一步电离,该极附近溶液中的氢氧根离子浓度大于氢离子浓度,溶液的pH升高;
(2)加氯化钡可以除去硫酸根离子,同时氯离子的进入不会引及杂质,但是加入Ba(OH)2、Ba(NO3)2会引进氢氧根离子和硝酸根离子等杂质离子,故答案为:C;
(3)将Ca2+、Mg2+等杂质转化为沉淀从而除去,对应方程式为Ca2++CO32- ==CaCO3、Mg2++2OH-=Mg(OH)2↓
(4)电解饱和食盐水的总反应化学方程式为2NaCl +2H2O==2NaOH+H2↑+Cl2↑。

练习册系列答案
相关题目