题目内容
【题目】碲(![]() )元素在元素周期表中位于第
)元素在元素周期表中位于第![]() 族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是
族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是![]() 、含
、含![]() 等杂质)中提取单质碲,步骤如下:
等杂质)中提取单质碲,步骤如下:
①将铜阳极泥在空气中焙烧使碲转化为![]() ;
;
②用![]() 溶液碱浸;
溶液碱浸;
③以石墨为电极电解②所得溶液获得![]() 。
。
已知:![]() 微溶于水,易与较浓的强酸、强碱反应。
微溶于水,易与较浓的强酸、强碱反应。
下列说法不正确的是
A.![]() 中,
中,![]() 的化合价是-2
的化合价是-2
B.步骤②中,碱浸的离子方程式是![]()
C.步骤③中,阴极上发生反应的电极方程式是:![]()
D.在阳极区溶液中检验出有![]() 存在,可能原因是阳极生成的氧气氧化
存在,可能原因是阳极生成的氧气氧化![]() 得到
得到![]()
【答案】C
【解析】
A. ![]() 中,
中,![]() 的化合价是-2,Cu的化合价是+1,故A正确;
的化合价是-2,Cu的化合价是+1,故A正确;
B. 步骤②中,根据信息![]() 易与较浓的强碱反应,因此碱浸的离子方程式是:
易与较浓的强碱反应,因此碱浸的离子方程式是:![]() ,故B正确;
,故B正确;
C. 步骤③中,溶液是碱性环境,因此阴极上发生反应的电极方程式是:![]() ,故C错误;
,故C错误;
D. 在阳极区溶液中检验出有![]() 存在,可能原因是阳极生成的氧气氧化
存在,可能原因是阳极生成的氧气氧化![]() 得到
得到![]() ,故D正确。
,故D正确。
综上所述,答案为C。

 名校课堂系列答案
名校课堂系列答案【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
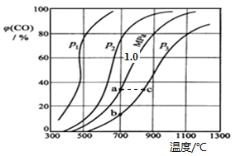
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
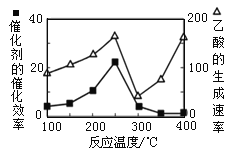
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA 表示阿伏加德罗常数)
消耗二氧化碳 | 生成碳酸钠 | 转移的电子 | |
A | 1 mol | 2NA | |
B | 22.4 L | 1 mol | |
C | 106 g | 1 mol | |
D | 106 g | 2NA |
A.AB.BC.CD.D