题目内容
【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
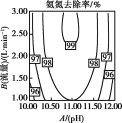
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。
【答案】400 97.56% CH3OH(g)![]() CO(g)+2H2(g) △H=+90kJ·mol-1 260℃ 反应i CO2+6e-+6H+=CH3OH+H2O
CO(g)+2H2(g) △H=+90kJ·mol-1 260℃ 反应i CO2+6e-+6H+=CH3OH+H2O
【解析】
(1)由表格可知,10min后,反应达到了平衡,根据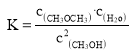 ,求平衡常数,根据
,求平衡常数,根据![]() ,求甲醇的平衡转化率;
,求甲醇的平衡转化率;
(2)①根据盖斯定律i+ii可得:CH3OH(g)![]() CO(g)+2H2(g),△H=△H1+△H2,据此求出△H;
CO(g)+2H2(g),△H=△H1+△H2,据此求出△H;
②由图可知,低于260℃时,CH3OH的转化率较低,高于260℃时,CH3OH的转化率较高,但在高于260℃时,CO的选择性逐渐增大,CO2的选择性逐渐减小。
③ CO2在酸性环境下,电解生成甲醇,二氧化碳得到电子,发生还原反应,生成甲醇,电极反应式为:CO2+6e-+6H+=CH3OH+H2O;
(1)由表格可知,10min后,反应达到了平衡,根据反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g), ;设甲醇的起始为xmol/L,根据三段式:
;设甲醇的起始为xmol/L,根据三段式:
2CH3OH (g) ![]() CH3OCH3 (g) + H2O (g)
CH3OCH3 (g) + H2O (g)
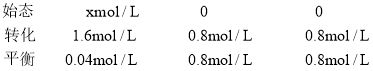
x=(1.6+0.04)mol/L=1.64mol/L,则![]() ,故答案为:400;
,故答案为:400;![]() ;
;
(2)① 反应i:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H1=+49kJmol-1;反应ii:H2(g)+CO2(g)
CO2(g)+3H2(g) △H1=+49kJmol-1;反应ii:H2(g)+CO2(g)![]() CO(g)+H2O(g) △H2=+41kJmol-1;根据盖斯定律i+ii可得:CH3OH(g)
CO(g)+H2O(g) △H2=+41kJmol-1;根据盖斯定律i+ii可得:CH3OH(g)![]() CO(g)+2H2(g),△H=△H1+△H2=49kJmol-1+41kJmol-1=+90kJ·mol-1,故答案为:CH3OH(g)
CO(g)+2H2(g),△H=△H1+△H2=49kJmol-1+41kJmol-1=+90kJ·mol-1,故答案为:CH3OH(g)![]() CO(g)+2H2(g) △H=+90kJ·mol-1。
CO(g)+2H2(g) △H=+90kJ·mol-1。
②由图可知,低于260℃时,CH3OH的转化率较低,高于260℃时,CH3OH的转化率较高,但在高于260℃时,CO的选择性逐渐增大,CO2的选择性逐渐减小,所以最适宜温度为260℃;随着温度的升高,催化剂对CO的选择性增大,CO2的选择性减小,所以温度升高,催化剂对反应i的选择性越低,故答案为:260℃;反应i。
③ CO2在酸性环境下,电解生成甲醇,二氧化碳得到电子,发生还原反应,生成甲醇,其电极反应式为:CO2+6e-+6H+=CH3OH+H2O,故答案为:CO2+6e-+6H+=CH3OH+H2O。

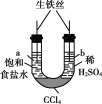
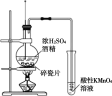
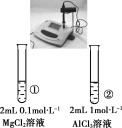
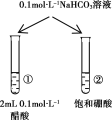
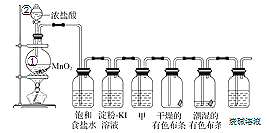
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
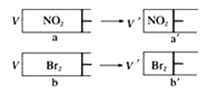
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D