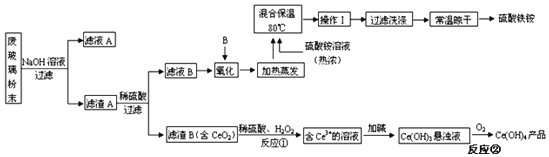
题目内容
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示(SO![]() 、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )
、OH表示自由基)。设阿伏加德罗常数的值为NA。下列叙述错误的是( )

A.过硫酸钠中-2价氧与-1价氧的个数比为3:1
B.若56gFe参加反应,共有1.5NA个S2O82被还原
C.碱性条件下硫酸根自由基发生反应的方程式为SO4-+OH-=SO42-+OH
D.pH越小,越有利于去除废水中的正五价砷
【答案】BD
【解析】
A.过硫酸钠中正负化合价之和为零,S为+6价,Na为+1价,正价之和=(+6)×2+(+1)×2=14,负价之和为-14,若-2价氧与-1价氧的个数比为3:1,即-2价氧为6个,-1价氧的个数为2个,负价之和为(-2)×6+(-1)×2=-14,故A正确;
B.56gFe为1mol,根据图示可知,1molS2O82和1molFe反应生成2molSO42和1molFe2+,该过程转移2mol电子,但是Fe2+还要与S2O82反应变成Fe3+和自由基,根据图示,形成的沉淀中即含有二价铁离子,又含有三价铁离子,即第一步反应中的二价铁没有被完全氧化为三价铁离子,因此1mol铁参加反应消耗小于1.5mol S2O82,共有少于1.5NA个S2O82被还原,故B错误;
C.结合图示可知,碱性条件下,SO4发生反应的方程式为:SO4+OH═SO42+OH,故C正确;
D.根据图示可知,最后是碱性条件下,铁离子和亚铁离子转化为氢氧化亚铁和氢氧化铁,正五价砷离子转变为沉淀,二者共同以沉淀形式析出的,则溶液的碱性越强越有利于析出,即pH越大越有利于去除废水中的正五价砷,故D错误;
答案选BD。

【题目】氢气还原 NO 的反应为![]() 。
。
(1)![]() 的电子式为________。
的电子式为________。
(2)已知几种共价键的键能如下:
共价键 | H-H |
| N-O | H-O |
键能/( | 436 | 946 |
| 464 |
根据上述数据计算,NO的键能![]() =___________。
=___________。
(3)![]() 的反应速率表达式为
的反应速率表达式为![]() (
(![]() 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。![]() 和
和![]() 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、![]() 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
序号 |
|
|
|
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.10 | 0.20 | 0.828 |
Ⅲ | 0.30 | 0.10 | 3.726 |
①![]() 中,
中,![]() =____,
=____,![]() =______。
=______。
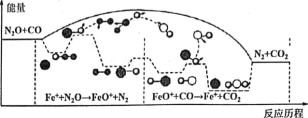
②经研究,有人提出上述反应分两步进行:![]() ;
;![]() 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能________(填“大于”“小于”或“等于”)(b)正反应活化能。
③1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:![]() [
[![]() 为反应速率常数,
为反应速率常数,![]() 为比例常数,
为比例常数,![]() 为自然对数的底数,
为自然对数的底数,![]() 为气体摩尔常数,
为气体摩尔常数,![]() 为开尔文温度,
为开尔文温度,![]() 为活化能
为活化能![]() ]。
]。![]() 反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
(4)一定温度下,在2 L恒容密闭容器中充入2 mol NO(g)、![]() 发生上述反应,混合气体压强随着时间变化关系如图所示。
发生上述反应,混合气体压强随着时间变化关系如图所示。
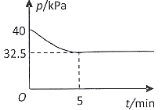
①05 min 内![]() 的平均速率
的平均速率 ![]() =___________________
=___________________![]() 。
。
②该温度下,上述反应的平衡常数![]() =________________
=________________![]() 。
。
③其他条件不变,在10min时向反应体系中再充入1mol NO、![]() ,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
(5)工业上,可以采用电化学方法处理NO。以惰性材料为电极,以硝酸铵溶液为电解质溶液并补充![]() ,电解反应为
,电解反应为![]() 。电解过程中,阳极的电极反应式为_______________________。
。电解过程中,阳极的电极反应式为_______________________。