题目内容
20.根据物质结构与元素周期律及周期表的知识,回答下列问题:(1)第三周期中,最活泼的非金属元素是(填元素名称)氯,其最高价氧化物的水化物的化学式是HClO4.
(2)某元素位于第三周期IVA族,该元素的元素符号是Si.
(3)若用M代表IA族元素,其最高价氧化物的水化物的化学式是MOH.
(4)某元素A与氟元素能形成离子化合物AF2.其中阴、阳离子的电子层结构相同,则A元素的元素符号是Mg.
(5)钾元素与铝元素位于不同周期和不同主族,但可以通过另一种元素作参照,比较出钾与铝的金属性强弱,这种参照元素是Na.
分析 (1)同周期元素的原子从左到右非金属的活泼性逐渐增强,对应的元素最高价氧化物的水化物的酸性逐渐增强,稀有气体元素除外;
(2)根据周期数等于电子层数,族序数等于最外层电子数解答;
(3)ⅠA族元素,其最高价氧化物的水化物是一元强碱;
(4)和氟离子电子层结构相同且为正二价的是镁元素;
(5)根据金属钾和金属镁在周期表中的位置关系来回答.
解答 解:(1)根据元素周期律:同周期元素从左到右非金属性逐渐增强,所以第三周期中,最活泼的非金属元素是Cl,最高价氧化物对应水化物为HClO4,
故答案为:氯;HClO4;
(2)某元素位于第三周期说明该元素含有三层电子,ⅣA族说明最外层电子数为4,则该元素质子数为14,为硅元素,符号为:Si,
故答案为:Si;
(3)ⅠA族元素的最高正价为+1价,其最高价氧化物对应水化物为MaOH,
故答案为:MOH;
(4)根据离子化合物AF2的化学式可以确定A显正二价,和氟离子电子层结构相同且为正二价的是镁离子,
故答案为:Mg;
(5)金属钾的上方是金属Na,Na和金属镁在周期表中位于同周期相邻的位置,所以比较出钾与镁的金属性强弱,可以选择Na为参照元素,
故答案为:Na.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,注意掌握原子结构与元素周期律、元素周期表的关系,比较出钾与铝的金属性强弱参照元素的选择是该题的难点,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.密闭容器中发生可逆反应:X2(g)+Y2(g)?2Z(g).已知起始时X2、Y2、Z各物质的浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,反应在一定条件下达到平衡时,各物质的物质的量浓度不可能是( )
| A. | c(Z)=0.3 mol•L-1 | B. | c(Y2)=0.35 mol•L-1 | ||
| C. | c(X2)=0.15 mol•L-1 | D. | c(Z)=0.4 mol•L-1 |
8.在气相中,关于BeF2和SF2的说法错误的是( )
| A. | BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2 | |
| B. | BeF2分子的立体结构为直线形 | |
| C. | SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子 | |
| D. | 在气相中,BeF2是直线形而SF2是V形 |
12.下列说法不正确的是( )
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2,从而有效降低酸雨的产生和危害 | |
| B. | FeCl2、CuS、SO3、NO2都不能由单质间直接化合得到 | |
| C. | SO2既可以由硫的化合物氧化得到,又可以由硫的化合物还原得到 | |
| D. | 硫为不溶于水,易溶于酒精和CS2的黄色粉末 |
9.下列说法中正确的是( )
| A. | 丙烯分子中有8个 σ 键,1个 π 键 | |
| B. | 在晶体中,1个Si原子和2个O原子形成2个共价键? | |
| C. | NCl3和 BCl3分子中,中心原子都采用sp3 杂化 | |
| D. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
10.甲、乙、丙、丁分别是Na2SO3、AgNO3、HCl、BaCl2四种无色溶液中的一种,它们两两反应后的现象如下:
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
| A. | Na2SO3 HCl AgNO3 BaCl2 | B. | BaCl2 Na2SO3 HCl AgNO3 | ||
| C. | BaCl2 Na2SO3 AgNO3 HCl | D. | AgNO3 HCl BaCl2 Na2SO3 |
 ;
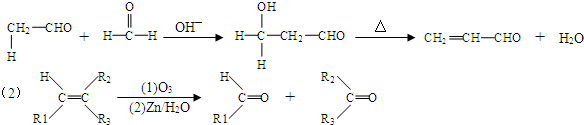
;
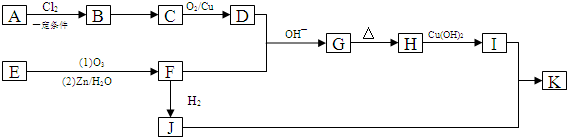
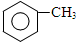 ,B→C的反应类型为:取代反应
,B→C的反应类型为:取代反应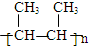
 +O2$→_{△}^{Cu}$ 2
+O2$→_{△}^{Cu}$ 2 +H2O;I+J→K:
+H2O;I+J→K: +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$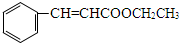 +H2O
+H2O .
.