题目内容
17.图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一.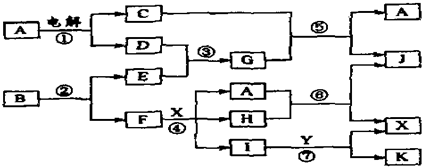
请按要求填空:
(1)写出下列物质的化学式:A:H2O,E:N2.
(2)写出下列方程式并回答:
i.实验室制取G的化学方程式2NH4 Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O.
ii反应④的离子方程式为:2H++NO3-+Ag=Ag++NO2↑+H2O.该反应中X的作用为酸性和氧化剂,当有0.3mole-转移时,参加反应的F为32.4g;
iii反应⑤的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,若使C过量,将所得产物收集在一个浸在冰水中的密闭容器中,则所得溶液的溶质质量分数为77.8%.
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为:AgN3.
分析 A是一种无色液体,A为H2O,G是一种极易溶于水的碱性气体,则G为NH3,由转化关系图可知,C为O2,D为H2,则E为N2,Y是胃酸的主要成分,Y为HCl,K是不溶于稀硝酸的白色沉淀,K为AgCl,反应⑤是工业制X的主要反应之一,则X为硝酸,反应⑤为氨气的催化氧化反应,再结合转化关系图可知,F为Ag,所以B中含有Ag、N两种元素,反应④为Ag与硝酸的反应,以此来解答.
解答 解:A是一种无色液体,A为H2O,G是一种极易溶于水的碱性气体,则G为NH3,由转化关系图可知,C为O2,D为H2,则E为N2,Y是胃酸的主要成分,Y为HCl,K是不溶于稀硝酸的白色沉淀,K为AgCl,反应⑤是工业制X的主要反应之一,则X为硝酸,反应⑤为氨气的催化氧化反应,再结合转化关系图可知,F为Ag,所以B中含有Ag、N两种元素,反应④为Ag与硝酸的反应,
(1)由上述推断可知A为H2O,E为N2,故答案为:H2O;N2;
(2)i、为NH3,实验室制备氨气是利用氢氧化钙和氯化铵固体加热反应生成,反应的化学方程式为:2NH4 Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案为:2NH4 Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
ii、反应④是为Ag与硝酸的反应,反应的离子方程式为:2H++NO3-+Ag=Ag++NO2↑+H2O,反应中X为浓硝酸,作用为氧化剂和酸性,每转移1mole-反应Ag物质的量为1mol,当有0.3mole-转移时,参加反应的Ag0.3mol,银的质量为0.3×108g/mol=32.4g,
故答案为:2H++NO3-+Ag=Ag++NO2↑+H2O,氧化剂和酸性,32.4g;
iii、反应⑤为氨气的催化氧化反应,氨气与氧气反应生成一氧化氮和水,反应的方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,若使C过量,将所得产物收集在一个浸在冰水中的密闭容器中,发生反应为;4NO+3O2+2H2O=4HNO3,依据反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O生成4molNO,同时生成6molH2O,则一氧化氮和氧气全部反应后得到溶液为硝酸溶液溶质硝酸为4mol,溶剂水为4mol,则所得溶液的溶质质量分数=$\frac{4mol×63g/mol}{4mol×63g/mol+4mol×18g/mol}$×100%=77.8%,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,77.8%;
(3)1molB通过反应2得到1molF,设B的化学式为AgNx,则$\frac{108}{108+14x}$×100%=72%,解得x=3,所以B的化学式为AgN3,故答案为:AgN3.
点评 本题考查无机物的推断,注意信息与转化图相结合来推断物质,反应定量关系的计算分析判断,熟悉物质的性质及转化中的各步反应是解答本题的关键,题目难度中等.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 实验室制快速氨气可用浓氨水滴加到固体NaOH中 | |
| B. | 漂白粉的成分是NaCl与NaClO | |
| C. | 水玻璃应保存在具橡皮塞的玻璃试剂瓶中 | |
| D. | NO气体的收集不能用排空气法 |
| A. | BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2 | |
| B. | BeF2分子的立体结构为直线形 | |
| C. | SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子 | |
| D. | 在气相中,BeF2是直线形而SF2是V形 |
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2,从而有效降低酸雨的产生和危害 | |
| B. | FeCl2、CuS、SO3、NO2都不能由单质间直接化合得到 | |
| C. | SO2既可以由硫的化合物氧化得到,又可以由硫的化合物还原得到 | |
| D. | 硫为不溶于水,易溶于酒精和CS2的黄色粉末 |
(1)该反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂用量/g | KMnO4酸性溶液浓度mol/L | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响 (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的 影响; |
| ② | ||||
| ③ | 323 | |||
| ④ |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(4)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色.(反应热效应不明显,可忽略不计),该反应的反应速率迅速加快的主要原因可能是反应生成的MnSO4作为该反应的催化剂.
| A. | 丙烯分子中有8个 σ 键,1个 π 键 | |
| B. | 在晶体中,1个Si原子和2个O原子形成2个共价键? | |
| C. | NCl3和 BCl3分子中,中心原子都采用sp3 杂化 | |
| D. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
| A. | 该溶液中由水电离的c(H+)<10-7mol/L | |
| B. | 该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| C. | 该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,且V1<V2 | |
| D. | 在上述溶液中加入适量NaOH,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| A. | 每一个化学反应都会伴随着能量变化 | |
| B. | 氯化氢溶于水氢氯共价键被破坏 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成,非金属元素之间不能形成离子化合物 |