题目内容
7.有关物质的燃烧热数据如下表所示,| 物质 | CH3OH(l) | CO(g) | CH3COOH(l) |
| △H/kJ•mol-1 | -727 | -283 | -875 |
| A. | -135kJ/mol | B. | -331kJ/mol | C. | +135kJ/mol | D. | +148kJ/mol |
分析 由物质燃烧热数据可知:①CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-727kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ•mol-1,
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-875kJ•mol-1,
根据盖斯定律,①+②-③可得:CH3OH(1)+CO(g)=CH3COOH(1),反应热也进行需要的计算.
解答 解:由物质燃烧热数据可知:①CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-727kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ•mol-1,
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-875kJ•mol-1,
根据盖斯定律,①+②-③可得:CH3OH(1)+CO(g)=CH3COOH(1),则△H=(-727kJ•mol-1)+(-283.0kJ•mol-1)-(-875kJ•mol-1)=-135kJ•mol-1,
故选:A.
点评 本题考查利用盖斯定律进行反应热有关计算,难度不大,根据燃烧热书写化学方程式,再构造目标热化学方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列说法中正确的是( )
| A. | 丙烯分子中有8个 σ 键,1个 π 键 | |
| B. | 在晶体中,1个Si原子和2个O原子形成2个共价键? | |
| C. | NCl3和 BCl3分子中,中心原子都采用sp3 杂化 | |
| D. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
10.甲、乙、丙、丁分别是Na2SO3、AgNO3、HCl、BaCl2四种无色溶液中的一种,它们两两反应后的现象如下:
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
甲+乙→沉淀,甲+丙→沉淀,乙+丙→沉淀,丙+丁→沉淀,乙+丁→无色刺激性气味气体,则甲、乙、丙、丁依次是( )
| A. | Na2SO3 HCl AgNO3 BaCl2 | B. | BaCl2 Na2SO3 HCl AgNO3 | ||
| C. | BaCl2 Na2SO3 AgNO3 HCl | D. | AgNO3 HCl BaCl2 Na2SO3 |
15.下列说法正确的是( )
| A. | 每一个化学反应都会伴随着能量变化 | |
| B. | 氯化氢溶于水氢氯共价键被破坏 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成,非金属元素之间不能形成离子化合物 |
2.构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A. | MgCl2 | B. | K2S | C. | NaOH | D. | SO3 |
12.有一位同学预测120号元素可能具有的性质中,不正确的是( )
| A. | 位于第八周期,第ⅡA族 | |
| B. | 最高价氧化物对应水化物具有强碱性 | |
| C. | 此元素的原子半径较大,熔沸点很高 | |
| D. | 属于人造元素,自然界不存在,并具有放射性 |
16.在反应SO2+2H2S═3S+2H2O中,氧化产物与还原产物的物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
17.根据如图有关图象,说法正确的是( )
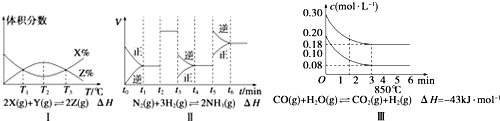

| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图Ⅱ知,反应在t6时刻,NH3体积分数最大 | |
| C. | 由图Ⅱ知,t3时采取降低反应体系压强的措施 | |
| D. | 图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量 |