题目内容
14.A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:(1)分别写出三只烧杯中形成分散系的名称:A悬浊液,B溶液,C胶体.
(2)写出B中形成分散系的离子方程式Fe3++3SCN-=Fe(SCN)3.
(3)写出C中形成分散系的化学方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3HCl.
分析 (1)氢氧化钠溶液中滴入FeCl3溶液会生成氢氧化铁沉淀;KSCN溶液中滴入FeCl3溶液会生成血红色溶液;煮沸的蒸馏水滴入FeCl3溶液会生成氢氧化铁胶体;
(2)书写硫氰酸铁生成的离子方程式;
(3)氯化铁滴入沸水中反应生成均一稳定的红褐色氢氧化铁胶体分散系;
解答 解:(1)氢氧化钠溶液中滴入FeCl3溶液发生复分解反应,生成氢氧化铁红褐色沉淀;分散系是悬浊液;KSCN溶液中滴入FeCl3溶液会生成血红色溶液硫氰酸铁络合物,分散系是溶液;煮沸的蒸馏水滴入FeCl3溶液加热到呈红褐色,会生成氢氧化铁胶体,分散系是胶体;
故答案为:悬浊液;溶液;胶体;
(2)KSCN溶液滴入FeCl3溶液,离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3 ;
(3)C中形成分散系是胶体,反应的化学方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
点评 本题考查了分散系的形成过程和概念判断,较简单,主要是离子方程式和化学方程式的书写.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
4.图表法、图象法是常用的科学研究方法.请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
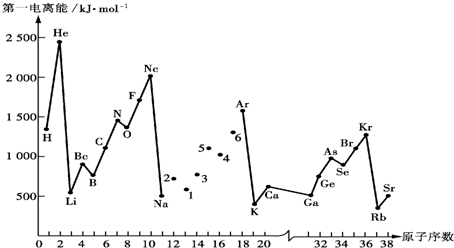
①将Na-Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图象.从上图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小
②上图折线中数字5代表元素在周期表中的位置是第三周期ⅤA族;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键(填离子键或共价键).
②某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(3)已知:波长为300nm的紫外光的光子所具有的能量约为399kJ/mol.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.

①将Na-Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图象.从上图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小
②上图折线中数字5代表元素在周期表中的位置是第三周期ⅤA族;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
②某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(3)已知:波长为300nm的紫外光的光子所具有的能量约为399kJ/mol.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
| C--C | C--N | C--S | |
| 键能 KJ/mol | 347 | 305 | 259 |
2.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol/L、0.001mol/L,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol/L)的用量均为2mL.
(1)该反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)某同学对实验①和②进行了三次实验测得以下实验数据(从混合振荡均匀开始计时):
计算用0.001mol•L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率:1×10-4mol?L-1?min-1.(忽略混合前后溶液的体积变化)
(4)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色.(反应热效应不明显,可忽略不计),该反应的反应速率迅速加快的主要原因可能是反应生成的MnSO4作为该反应的催化剂.
(1)该反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂用量/g | KMnO4酸性溶液浓度mol/L | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响 (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的 影响; |
| ② | ||||
| ③ | 323 | |||
| ④ |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(4)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色.(反应热效应不明显,可忽略不计),该反应的反应速率迅速加快的主要原因可能是反应生成的MnSO4作为该反应的催化剂.
9.下列说法中正确的是( )
| A. | 丙烯分子中有8个 σ 键,1个 π 键 | |
| B. | 在晶体中,1个Si原子和2个O原子形成2个共价键? | |
| C. | NCl3和 BCl3分子中,中心原子都采用sp3 杂化 | |
| D. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
6.常温下经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),其可能的情形是( )
| A. | 该溶液中由水电离的c(H+)<10-7mol/L | |
| B. | 该溶液由0.1mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| C. | 该溶液由V1L c mol/L的CH3COOH溶液与V2Lc mol/L的NaOH溶液混合而成,且V1<V2 | |
| D. | 在上述溶液中加入适量NaOH,可使溶液中离子浓度改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
3.下列各组物质,既不是同系物也不是同分异构体的是( )
| A. | 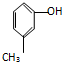 和 和  | B. | 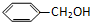 和 和  | ||
| C. | (CH3)2C(OH)CH2CH3 和CH3CH2OH | D. | CH3CH2OH 和 CH3CH2OCH2CH3 |
12.有一位同学预测120号元素可能具有的性质中,不正确的是( )
| A. | 位于第八周期,第ⅡA族 | |
| B. | 最高价氧化物对应水化物具有强碱性 | |
| C. | 此元素的原子半径较大,熔沸点很高 | |
| D. | 属于人造元素,自然界不存在,并具有放射性 |
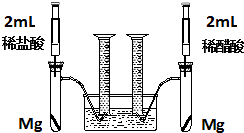 实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图: