题目内容
4.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )| A. | 元素非金属性由强到弱的顺序是:X>Y>Z | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
分析 X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一族,故Y为硫元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为磷元素,结合元素周期律解答.
解答 解:X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一族,故Y为硫元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为磷元素,
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,所以非金属性O>S>P,即X>Y>Z,故A正确;
B.Y为硫元素,最高价氧化物对应水化物的化学式可表示为H2SO4,故B错误;
C.非金属性P<S<O,非金属性越强,氢化物越稳定,所以氢化物稳定性Z<Y<X,则Z的氢化物的稳定性最弱,故C错误;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,所以原子半径P>S>O,即Z>Y>X,故D正确,
故选AD.
点评 本题考查结构与位置关系、元素周期律等,难度不大,推断元素是关键,突破口为X原子的最外层电子数是其电子层数的3倍,注意对元素周期律的掌握.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
14.用化学试剂鉴别下列各组物质,填写所用试剂和相应的实验现象.
| 鉴别对象 | 所用试剂 | 实验现象 |
| 苯和苯酚 | 加入FeCl3溶液 | 苯无现象,苯酚溶液呈紫色 |
| 苯和甲苯 | 加入酸性高锰酸钾溶液 | 苯不能使高锰酸钾溶液褪色,甲苯能使高锰酸钾溶液褪色 |
15.中和热是在稀溶液中,强酸、强碱发生中和反应生成1mol水时放出的热量,中和热为57.3kJ/mol.下列热化学方程式中正确的是( )
| A. | HNO3(aq)+KOH(aq)═H2O(l)+KNO3(aq)△H>-57.3 kJ/mol | |
| B. | HNO3(aq)+NH3•H2O(aq)═H2O(l)+NH4NO3(aq)△H<-57.3 kJ/mol | |
| C. | CH3COOH(aq)+KOH(aq)═H2O(l)+CH3COOK(aq)△H<-57.3 kJ/mol | |
| D. | CH3COOH(aq)+NH3•H2O(aq)═H2O(l)+CH3COONH4(aq)△H>-57.3 kJ/mol |
19.${\;}_{6}^{13}$C-NMR(核磁共振)可以用于含碳化合物的结构分析,${\;}_{6}^{13}$C表示的碳原子( )
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
9.氢气可以在氧气中燃烧.在该反应中:断裂1mol H-H键消耗的能量为Q1kJ,断裂1mol O=O键消耗的能量为Q2kJ,形成1mol H-O键释放的能量为Q3 kJ.下列关系式中,正确的是( )
| A. | 2Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
16.铜~锌原电池如图所示,电解质溶液为稀硫酸,下列说法不正确的是( )
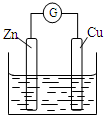

| A. | 铜电极上发生还原反应 | B. | 锌电极是原电池的负极 | ||
| C. | 电子从铜极经过外电路流向锌极 | D. | 锌电极上的反应为Zn-2e-═Zn2+ |
13.下列变化属于化学变化的是( )
| A. | 氨的液化 | B. | 氯化铵受热“升华” | ||
| C. | 碘的升华 | D. | 硝酸的挥发 |
14.氡(${\;}_{86}^{222}$Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中源源不断地释放出来.它可通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线.这些射线可诱发肺癌.关于氡的下列叙述不正确的是( )
| A. | Rn的原子核内中子数与质子数的差值为50 | |
| B. | Rn位于元素周期表中第六周期0族 | |
| C. | Rn的最外层电子排布式为6s26p6,化学性质不活泼 | |
| D. | 新铺大理石地面的居室,不用打开门窗换气,因为氡对人体无危害 |
 ;物质⑤的结构式O=C=O.
;物质⑤的结构式O=C=O.