题目内容
11.已知X元素原子的L电子层比Y元素原子的L电子层少2个电子,Y元素原子核外电子总数比X元素核外电子总数多3个,则下列说法不正确的是( )| A. | X与Y能形成两种化合物,但化学键类型不相同 | |
| B. | Y与氢形成化合物YH,分子内存在离子键 | |
| C. | X与氢可形成化合物H2X2,分子内部存在极性键和非极性键 | |
| D. | Y2X2中阴、阳离子个数比1:2 |
分析 X元素的L层比Y元素的L层多2个电子,说明X的L层电子数小于8,X应为第二周期元素,Y元素原子的核外电子总数比X元素原子的核外电子总数多3个,说明Y应含有M层电子,故X的最外层电子数为8-2=6,故X为O元素,Y原子核外电子数总数为8+3=11,故Y为Na元素,以此解答该题.
解答 解:X元素的L层比Y元素的L层多2个电子,说明X的L层电子数小于8,X应为第二周期元素,Y元素原子的核外电子总数比X元素原子的核外电子总数多3个,说明Y应含有M层电子,故X的最外层电子数为8-2=6,故X为O元素,Y原子核外电子数总数为8+3=11,故Y为Na元素.
A.O和Na可形成Na2O或Na2O2,前者含有离子键,后者含有离子键、共价键,故A正确;
B.Y与氢形成化合物NaH,属于离子晶体,不是分子晶体,故B错误;
C.X与氢可形成化合物H2O2,分子内部存在极性键和非极性键,故C正确;
D.Na2O2中阴、阳离子个数比1:2,故D正确,
故选B.
点评 本题考查原子结构与元素性质,侧重于学生的分析能力和推断能力的考查,注意把握元素结构的特点和规律,B选项为易错点,学生容易只考虑离子键,忽略题目中描述的“分子”,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.2000年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂.苯丙醇胺(英文缩写为PPA)结构简式如下: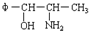 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
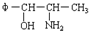 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
19.臭氧(O3)和汽车尾气造成的大气污染物NO发生如下反应:NO+O3=NO2+2O、NO2+O=NO+O2从反应过程和最终产物分析判断,NO是( )
| A. | 氧化剂和还原产物 | B. | 还原剂和氧化产物 | ||
| C. | 氧化剂和催化剂 | D. | 还原剂和催化剂 |
6.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构.例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为:
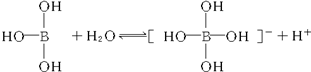
下列判断正确的是( )
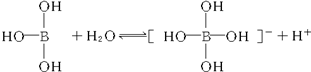
下列判断正确的是( )
| A. | 凡是酸或碱对水的电离都是抑制的 | |
| B. | 硼酸分子中除氢原子外每个其他原子最外层都满足8电子稳定结构 | |
| C. | 硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
16.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物与其最高价氧化物的水化物能形成离子化合物,Y与Q同主族;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Z的最高价氧化物的水化物显两性 | |
| B. | XY3中的X呈+3价 | |
| C. | Y最高价氧化物水化物的酸性比W的强 | |
| D. | Z与Q形成的是离子化合物 |
3.向2L密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+2N(g)?E(g),当反应进行到4min时,测知M的浓度为0.2mol/L,则化学反应的平均速率( )
| A. | v(M)=0.4 mol/(L•min) | B. | v(N)=0.4 mol/(L•min) | ||
| C. | v(M)=0.8 mol/(L•min) | D. | v(E)=0.45 mol/(L•min) |
20.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
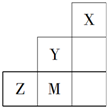

| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
1.碳元素有的三种原子:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C,下列各项对三种原子均不同的是( )
| A. | 元素种类 | B. | 核电荷数 | C. | 电子层数 | D. | 中子数 |