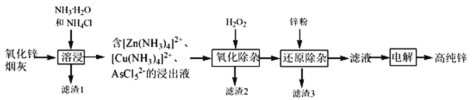
题目内容
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子核外电子排布式为___。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___ (填序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
II中转化的基本反应类型是___,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
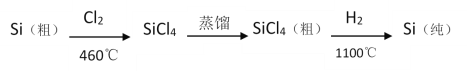
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得生成7kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___。
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目___。
【答案】1s22s22p5 bc 复分解反应 室温下,氯酸钾在水中溶解度明显小于其他晶体  SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ
SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ 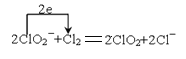
【解析】
(1)与氯元素同族的短周期元素原子为F,核外有9个电子,F的核外电子排布式为1s22s22p5;
(2)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc;
(3)NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;
(4)SiCl4为共价化合物,氯原子和硅原子都达到8个电子,SiCl4的电子式为: ;7kg纯硅的物质的量为:
;7kg纯硅的物质的量为:![]() =250mol,生成250mol硅吸收akJ热量,则生成1mol硅吸收的热量为:
=250mol,生成250mol硅吸收akJ热量,则生成1mol硅吸收的热量为:![]() =0.004akJ,所以SiCl4与氢气反应生成单质硅和氯化氢的热化学方程式为:2H2(g)+SiCl4(g)=Si(s)+4HCl(g) △H=+0.004akJ·mol-1或SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ;
=0.004akJ,所以SiCl4与氢气反应生成单质硅和氯化氢的热化学方程式为:2H2(g)+SiCl4(g)=Si(s)+4HCl(g) △H=+0.004akJ·mol-1或SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ;
(5)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,反应的离子方程式和电子转移为: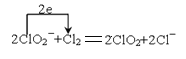 。
。

 名校课堂系列答案
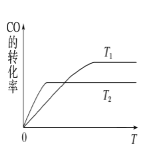
名校课堂系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)=4NO2(g)+O2(g),△ H>0, T1温度时,向密闭容器中通入N2O5,部分实验数据见表下列说法中不正确的是
时间/s | 0 | 500 | 1000 | 1500 |
c (N2O5) /rnol/L | 5.00 | 3.52 | 2.50 | 2.50 |
A. 500s内用O2表示的平均速率为1.48×10-3mol/(L-s)
B. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
C. T1温度下N2O5的平衡转化率为50%
D. 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时 c(N2O5)>5.00mol/L