题目内容
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________;该反应在________条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
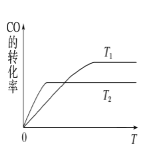
①T1________T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________(填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________;
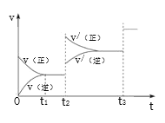
t3时采取的措施可能是 _________________。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________;正极的电极反应为_______________________。
【答案】C(s)+H2O(g)=CO(g)+H2(g)△H =+131.6kJ·mol-1 高温 < > cd 加压 加入催化剂 66.7 CH3OH O2+4e-+2H2O =4OH—
【解析】
(1)1.2 g 碳为0.1mol,与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量,反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H =+131.6kJ·mol-1;该反应的正反应为吸热反应,且气体分子数增大的反应,自发进行△G=△H-T△S<0,该反应的△H>0,△S>0,所以高温条件下才自发进行;故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H =+131.6kJ·mol-1;高温;
(2)①温度越高,反应速率越快,由图可知T1<T2,温度高,一氧化碳的转化率小,该反应的正反应为放热反应,温度升高,平衡逆向移动,平衡常数变小,所以K1>K2;故答案为:< ;>;
②a. 降低温度,平衡正向移动,CO转化率增大;不选a;
b. 将CH3OH(g)从体系中分离,平衡正向移动,CO转化率增大;不选b;
c. 催化剂对平衡无影响,不能增加CO转化率,选c;
d. 充入He,体系总压强增大,各组分的浓度不变,平衡不移动,选d;故答案为:cd;
③CO(g)+2H2(g)![]() CH3OH(g)△H<0,由图可知,t2时,改变外界环境,速率加快,平衡正向移动,所以加压;t3时,改变外界环境,速率加快,平衡不移动,所以加入催化剂;故答案为:加压;加入催化剂;
CH3OH(g)△H<0,由图可知,t2时,改变外界环境,速率加快,平衡正向移动,所以加压;t3时,改变外界环境,速率加快,平衡不移动,所以加入催化剂;故答案为:加压;加入催化剂;
④设转化的一氧化碳的物质的量为xmol,则:
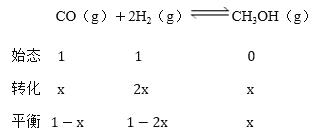
根据物质的量与压强成正比关系,得到:![]() ,
,![]() ,x=0.4mol,则,
,x=0.4mol,则, (MPa)-2;故答案为:66.7;
(MPa)-2;故答案为:66.7;
(3)燃料电池中,燃料作负极,发生氧化反应,失去电子;氧气作正极,发生还原反应,得到电子,所以负极加入的物质为CH3OH,电解质溶液为碱,在碱性环境中,O2+4e-+2H2O =4OH-;故答案为:CH3OH;O2+4e-+2H2O =4OH-。

【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂,实验室可用“溢流法”连续制备。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置如图所示:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1

可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)Sn在周期表中的位置为_______________
(2)a管的作用是_______________,A中反应的离子方程式是______________。
(3)装置D的作用是________________,装置E中冷却水的作用是___________。
(4)加热Sn粒之前要先让氯气充满整套装置,其目的是___________________。
(5)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.蒸馏 d.过滤
(6)尾气处理时,可选用的装置是________(填序号)。

(7)SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还可以看到大量白雾,化学方程式为___________________________________。