题目内容
【题目】含硫化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。回答下列问题:
1.SO2具有还原性,写出将SO2气体通入 FeCl3溶液中的离子方程式_________,并标出电子转移的数目及方向。_____________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7Ki2=5.6×10-11
含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________
常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
【答案】2Fe3++SO2+2H2O=2Fe2++4H++SO42- ![]() 有白色沉淀生成,溶液红色褪去 亚硫酸钠溶液水解成碱性,滴入酚酞成红色。SO32- + H2O
有白色沉淀生成,溶液红色褪去 亚硫酸钠溶液水解成碱性,滴入酚酞成红色。SO32- + H2O![]() HSO3-+ OH-,加入氯化钡后,Ba2++SO32-→BaSO3↓,降低了SO32-的浓度,使得水解平衡往左移动,导致溶液中OH-浓度降低,因此溶液红色褪去 中 H+与OH-、SO42-与Cl- H2S + CO32-→HS-+ HCO3- >
HSO3-+ OH-,加入氯化钡后,Ba2++SO32-→BaSO3↓,降低了SO32-的浓度,使得水解平衡往左移动,导致溶液中OH-浓度降低,因此溶液红色褪去 中 H+与OH-、SO42-与Cl- H2S + CO32-→HS-+ HCO3- >
【解析】
1.SO2具有还原性,能被氯化铁氧化为单质S,反应的离子方程式为2Fe3++SO2+2H2O→2Fe2++4H++SO42-,其中电子转移的数目及方向可表示为![]() ;
;
2.在Na2SO3溶液中滴加酚酞,溶液变红色,说明亚硫酸根水解,溶液显碱性。若在该溶液中滴入过量的BaCl2溶液,则生成亚硫酸钡沉淀,抑制亚硫酸根的水解,溶液碱性降低,所以实验现象是有白色沉淀生成,溶液红色褪去;
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,二者恰好发生氧化还原反应生成硫酸钠和氯化钠,因此溶液显中性,此时根据电荷守恒可知溶液中浓度相等的微粒是H+与OH-、SO42-与Cl-;
4.已知:H2S:Ki1=1.3×10-7Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7Ki2=5.6×10-11,这说明酸性是H2CO3>H2S>HCO3—>HS—,则根据较强酸制备较弱酸可知含H2S尾气用足量的Na2CO3溶液来吸收反应的离子反应方程式为H2S + CO32-→HS-+ HCO3-。常温时,等体积等浓度的Na2S和Na2CO3溶液中碳酸根的水解程度小于硫离子的水解程度,即碱性是碳酸钠弱于硫化钠。根据电荷守恒可知在碳酸钠溶液中有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),在硫化钠溶液中有c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),等浓度的两溶液中,c(Na+)相同,所以溶液中的离子总数N前>N后。

【题目】判断下列各物质所属的类别,并把相应的序号填入表中。
①![]() ②
②![]() ③
③ ④
④ ⑤
⑤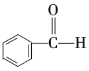 ⑥
⑥ ⑦
⑦ ⑧
⑧![]() ⑨
⑨![]() ⑩
⑩![]()
![]()
![]()
分类 | 芳香烃 | 卤代烃 | 醇 | 酚 | 醛 | 酮 | 羧酸 | 酯 |
物质 | ________ | _________ | ________ | _________ | _________ | ________ | p>________ | ________ |
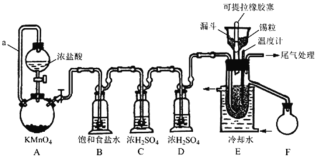
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂,实验室可用“溢流法”连续制备。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置如图所示:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)Sn在周期表中的位置为_______________
(2)a管的作用是_______________,A中反应的离子方程式是______________。
(3)装置D的作用是________________,装置E中冷却水的作用是___________。
(4)加热Sn粒之前要先让氯气充满整套装置,其目的是___________________。
(5)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是________。实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.蒸馏 d.过滤
(6)尾气处理时,可选用的装置是________(填序号)。

(7)SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还可以看到大量白雾,化学方程式为___________________________________。