题目内容
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”,现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
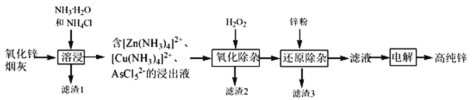
请回答下列问题:
(1)《天工开物》中炼锌的方法中“泥封”的目的是____________。
(2)滤渣1的主要成份分别是_______(填化学式),“过滤”用到的玻璃仪器是__________。
(3) “溶浸”时,氧化铜参与反应的相关离子方程式是________;“溶浸”时可以适当升高温度,但不宜过高,其原因是________________。
(4) “氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是_____________________。
(5) “电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是_________。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_______(写化学式)。
【答案】防止得到的锌被氧化 Pb 烧杯、漏斗、玻璃棒 CuO+2NH3+2NH4+=[Cu(NH3)4]2++H2O或CuO+2NH3H2O +2NH4+=[Cu(NH3)4]2++3H2O 避免氨水的分解与挥发 2AsCl52-+2H2O2+6 NH3·H2O=As2O5(胶体)+10Cl-+6 NH4++5H2O或2AsCl52-+2H2O2+6NH3+H2O=As2O5(胶体)+10Cl-+6NH4+ [Zn(NH3)4]2++2e-= Zn+4NH3↑ N2
【解析】
“火法”冶炼锌时采用泥封,从锌的活泼型考虑,是为了隔绝空气。由流程可知,氧化锌烟灰加入氨水、氯化铵进行溶浸,溶浸后氧化锌烟灰中ZnO 、少量Pb、CuO和As2O3分别以Zn(NH3)42+、Cu(NH3)42+、AsCl52-的形式存在,滤渣1为Pb,加入过氧化氢,AsCl52-转化为As2O5胶体吸附聚沉除去,过滤后加入锌粉还原,可除去[Cu(NH3)4]2+等,滤液主要含有[Zn(NH3)4]2+,电解可生成高纯度锌,以此解答该题。
(1). “火法”冶炼锌时,由于锌是比较活泼的金属,“泥封”的目的是防止锌被氧化,
故答案为:防止得到的锌被氧化;
(2).由以上分析可知滤渣1为Pb, “过滤”用到的玻璃仪器是烧杯、漏斗、玻璃棒,
故答案为:Pb;烧杯、漏斗、玻璃棒;
(3). “溶浸”时,氧化铜加入氨水和氯化铵时,将氧化铜转化为[Cu(NH3)4]2+,反应的离子方程式为:CuO+2NH3+2NH4+=[Cu(NH3)4]2++H2O或CuO+2NH3H2O +2NH4+=[Cu(NH3)4]2++3H2O;温度太高时,氨水易分解和挥发,所以温度不宜过高,可避免氨水的分解和挥发,
故答案为:CuO+2NH3+2NH4+=[Cu(NH3)4]2++H2O或CuO+2NH3H2O +2NH4+=[Cu(NH3)4]2++3H2O;避免氨水的分解与挥发;
(4). “氧化除杂”中,AsCl52转化为As2O5胶体吸附聚沉除去,反应的离子方程式为2AsCl52-+2H2O2+6 NH3·H2O=As2O5(胶体)+10Cl-+6 NH4++5H2O或2AsCl52-+2H2O2+6NH3+H2O=As2O5(胶体)+10Cl-+6NH4+
故答案为:2AsCl52-+2H2O2+6 NH3·H2O=As2O5(胶体)+10Cl-+6 NH4++5H2O或2AsCl52-+2H2O2+6NH3+H2O=As2O5(胶体)+10Cl-+6NH4+;
(5). “电解”时Zn(NH3) 42+在阴极放电,发生还原反应生成锌,电极反应式为:[Zn(NH3)4]2++2e-= Zn+4NH3↑,阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,说明气体没有氧化性,该气体是氮气,
故答案为:[Zn(NH3)4]2++2e-= Zn+4NH3↑;N2。

 名校课堂系列答案
名校课堂系列答案