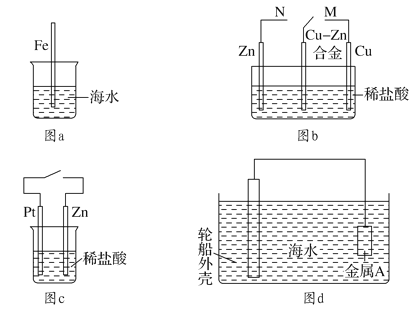
题目内容
【题目】硫酸是一种重要的工业原料,广泛应用于炼油、冶金、染料等工业中。硫酸性质是中学化学学习的重点。
请回答下列问题:
(1)写出中学化学中利用物质与浓硫酸共热产生不同类别的两种气体的名称:___、___。
(2)浓硫酸脱水性实验教材中如下操作:取20g蔗糖置200mL烧杯中,加2mL水,搅拌均匀。再加入20mL98%的浓硫酸,迅速搅拌,静置。实验中,生产大量含SO2、CO2等混合气体。写出产生该混合气体的化学方程式:___。
(3)有学生改进了浓硫酸的脱水性实验(装置如图):
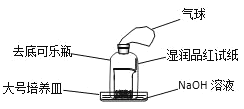
实验准备就绪后,加入浓硫酸,迅速搅拌后用去底可乐瓶罩上,观察现象。除看到烧杯中白色蔗糖颜色变深,体积膨胀,有气体产生外,还可看到哪些现象?___。
(4)图中,仪器a、b的名称分别是___、___;其中,仪器b常用于操作___(填一种物质提纯操作)。

(5)有学生为了确定浓硫酸使蔗糖脱水过程中产生SO2、CO2气体,请选用上述装置(可重复使用)设计实验,将它们的编号填入方框,并将装置内所放的化学药品填入括号内___。
![]()
(浓硫酸,蔗糖)________________________。
【答案】氯化氢 乙烯 C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O 品红试纸褪色、可乐瓶中液面稍上升、气球先鼓胀,后又逐渐瘪掉 长颈漏斗 分液漏斗 分液或萃取分液 BCCC 品红试液 溴水或酸性高锰酸钾 品红试液或溴水或酸性高锰酸钾 澄清石灰水
2SO2↑+CO2↑+2H2O 品红试纸褪色、可乐瓶中液面稍上升、气球先鼓胀,后又逐渐瘪掉 长颈漏斗 分液漏斗 分液或萃取分液 BCCC 品红试液 溴水或酸性高锰酸钾 品红试液或溴水或酸性高锰酸钾 澄清石灰水
【解析】
(1)实验室用氯化钠和浓硫酸反应制取氯化氢,用乙醇在浓硫酸的作用下加热反应制取乙烯气体;
(2)浓硫酸具有氧化性,能氧化碳单质;
(3)根据碳单质、浓硫酸以及SO2的性质来回答;
(4)根据实验仪器的名称和用途来回答判断;
(5) SO2的检验用品红,CO2的检验用澄清石灰水,检验CO2之前先是将SO2除净。
(1)实验室用氯化钠和浓硫酸反应制取氯化氢,用乙醇在浓硫酸的作用下加热反应制取乙烯气体;
(2)浓硫酸具有氧化性,能氧化碳,反应方程式为:C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(3)浓硫酸具有氧化性,能氧化碳,生成CO2、SO2,气球先鼓胀,其中的SO2具有漂白性,使得品红试纸会褪色,SO2、CO2均会合NaOH发生反应,使得气压降低,所以可乐瓶中液面稍上升,气球会逐渐瘪掉;
(4)仪器a、b的名称分别是长颈漏斗、分液漏斗,分液漏斗用于互不相溶液体的分液或萃取分液;
(5)浓硫酸使蔗糖脱水过程中产生SO2、CO2气体,B是发生装置。SO2的检验用品红,CO2的检验用澄清石灰水,检验CO2之前先是将SO2除净,所以C中装品红,褪色证明产生了SO2,在经过盛有溴水或高锰酸钾的试剂瓶,将SO2吸收,再经过品红看是否将SO2除尽,如果溴水或高锰酸钾不褪色,最后用澄清石灰水检验CO2的生成。故答案为:B、C、C、C;品红试液、溴水或酸性高锰酸钾、品红试液或溴水或酸性高锰酸钾、澄清石灰水。

 高中必刷题系列答案
高中必刷题系列答案【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。所发生的转化过程为![]() 。
。
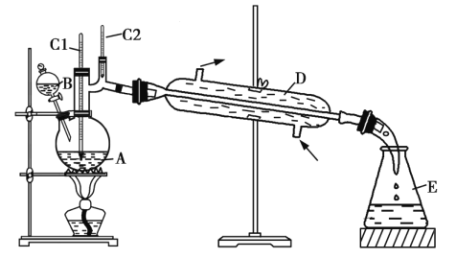
反应物和产物的相关物理性质如表所示。
性质 | 沸点 | 密度 | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将![]()
![]() 放入
放入![]() 烧杯中,加
烧杯中,加![]() 水溶解,再缓慢加入
水溶解,再缓慢加入![]() 浓硫酸,将所得溶液小心转移至
浓硫酸,将所得溶液小心转移至![]() 中。在
中。在![]() 中加入
中加入![]() 正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加
正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加![]() 中溶液。滴加过程中保持反应温度为
中溶液。滴加过程中保持反应温度为![]() ,在
,在![]() 中收集
中收集![]() 以上的馏分。将馏出物倒入分液漏斗中,分去水层,将有机层干燥后蒸馏,收集
以上的馏分。将馏出物倒入分液漏斗中,分去水层,将有机层干燥后蒸馏,收集![]() 馏分,产量为
馏分,产量为![]() 。
。
回答下列问题:
(1)实验中,能否将![]() 溶液加入浓硫酸中,说明理由:________________。
溶液加入浓硫酸中,说明理由:________________。
(2)加入沸石的作用是______________,若加热后发现未加入沸石,应采取的正确措施是_____________。
(3)上述装置图中,![]() 仪器的名称是______,D仪器的名称是______。
仪器的名称是______,D仪器的名称是______。
(4)将正丁醛粗产品置于分液漏斗中分离水时,水在______(填“上”或“下”)层。
(5)反应温度应保持在![]() ,其原因是______________________________。
,其原因是______________________________。
(6)本实验中,正丁醛的产率为______![]() 。
。