题目内容
【题目】有机化合物键线式的特点是以线表示键,每个拐点和端点均表示有一个碳原子,并以氢原子补足四价,C、H不表示出来,某有机化合物的立体结构如图所示。

(1)写出该有机化合物的分子式____。
(2)该有机化合物属于___。
A.环烷烃 B.饱和烃
C.不饱和烃 D.芳香烃
【答案】C7H12 AB
【解析】
此有机物为环状有机物,只含有C、H原子,共有7个拐点,每个拐点处都有1个C原子,H原子数可利用碳的四价原则进行计算;该有机物所属类别,可根据有机物的分类进行分析。
(1)根据键线式可知,该有机化合物有7个碳原子,因为碳原子可以形成四个共价键,故拐点的5个碳原子上各连有2个氢原子,中间2个碳原子上各连有1个氢原子,故氢原子数目为5×2+2×1=12,该有机化合物的分子式是C7H12。答案为:C7H12;
(2)该有机化合物只含有碳、氢两种元素,所以属于烃;分子中碳碳间都形成单键,且形成环状,所以是环状饱和烃。综合以上分析,该有机物为环烷烃,故选AB。答案为:AB。

 互动英语系列答案
互动英语系列答案【题目】![]() 时,将
时,将![]() 的某一元酸HA与
的某一元酸HA与![]() 的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是
的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是![]()
微粒 |
|
|
|
浓度 |
|
|
|
A.所得溶液中:![]()
B.![]() 时,水的离子积
时,水的离子积![]()
C.![]() 时,一元酸HA的电离常数
时,一元酸HA的电离常数![]()
D.![]() 时,
时,![]() 溶液中
溶液中![]() 的水解率为
的水解率为![]()
【题目】称取58.7克Ba(OH)2和BaCl2固体混合物,配成500mL溶液,把该溶液分成5等份后分别加入相同浓度不同体积的NaHCO3溶液,生成沉淀的质量如下表。已知加入NaHCO3溶液体积为80.0mL时,反应后溶液呈中性。
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
NaHCO3溶液(mL) | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
沉淀的质量(g) | 1.97 | 3.94 | 5.91 | 7.88 | 7.88 |
(1)NaHCO3溶液中溶质的物质的量浓度______________________。
(2)原固体混合物中Ba(OH)2和BaCl2的物质的量之比__________________________。
【题目】几种短周期元素的原子半径及主要化合价如下表
元素代号 | X | Y | Z | M | R | w |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 | 0.077 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 | +4 -4 |
已知:X是短周期中最活泼的金属,且与R同周期。请用相应的化学用语或者化学符号回答下列问题。
(1)R在元素周期表中的位置为________________。
(2)X与M按原子个数比1:1构成的物质的电子式为_____________;所含化学键类型___________。
(3)X+、Y2-、M2-、R3+离子半径大小顺序为__________________________(用离子符号表示)。
(4)请用电子式表示WY2的形成过程___________________________________。
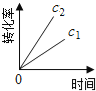
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.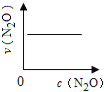 B.
B.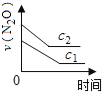 C.
C.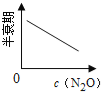 D.
D.