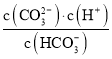题目内容
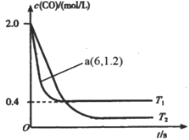
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是

A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中![]() 减小
减小
C.b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-)
D.c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-)
【答案】D
【解析】
A、氯气和氢氧化钠反应生成氯化钠和次氯酸钠,次氯酸钠有强氧化性,能漂白,所以不能测其pH值,错误,不选A;
B、从a到b,溶液的pH逐渐变小,说明氢离子和氢氧根离子浓度比值变大,错误,不选B;
C、b点是氯水的饱和溶液,由于盐酸电离和次氯酸电离,所有氢离子浓度比氯离子浓度大,错误,不选C;
D、根据电荷守恒,在c点溶液为中性,氢离子浓度等于氢氧根离子浓度,所以正确,选D;
故答案选D。

练习册系列答案
相关题目