题目内容
20. BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )| A. | 共价键 | B. | 离子键 | C. | 配位键 | D. | 范德华力 |
分析 由结构可信息可知,(H2O)2•BF3晶体为分子晶体,一定不含离子键,以此来解答.
解答 解:(H2O)2•BF3晶体中含O-H、B-F共价键,含分子之间的范德华力、氢键,且B原子提供空轨道、O原子提供孤电子对,则B原子和O原子之间存在配位键,则不涉及的是离子键,故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及类型是为解答的关键,注意配位键为共价键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.硫晶体熔化或气化时,下述各项中发生变化的是( )
| A. | 化学键 | B. | 中心原子杂化类型 | ||
| C. | 分子构型 | D. | 分子间作用力 |
11.据报道,放射性的${\;}_{53}^{125}$I对治疗肿瘤有一定疗效.该原子的原子核内的中子数是( )
| A. | 72 | B. | 53 | C. | 19 | D. | 125 |
15.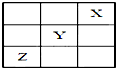 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Y元素在周期表的第3周期ⅥA族 | |
| C. | Y元素基态原子的价电子排布为4s24p4 | |
| D. | Z元素基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
12.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 C>D>B>A | B. | 原子序数 a>b>d>c | ||
| C. | 离子半径 A>B>D>C | D. | 元素失电子能力 A>B>D>C |
9.能在水溶液中大量共存的一组离子是( )
| A. | Fe2+、Mg2+、SO42-、NO3- | B. | Na+、Ag+、Br-、PO43- | ||
| C. | Ba2+、K+、SO32-、ClO- | D. | Al3+、NH4+、CO32-、Cl- |
17.下列各组离子能大量共存的是( )?
| A. | K+、NH4+、SO42-、NO3- | B. | OH-、K+、NH4+、Cl- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | Fe2+、H+、SO32-、NO3- |
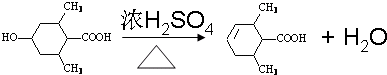
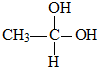 →CH3-CHO+H2O
→CH3-CHO+H2O
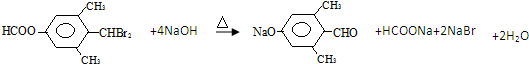
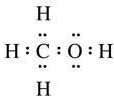 .
. ;
; ;
; ;
;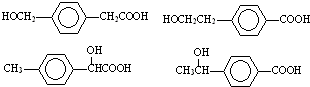 任意一种.
任意一种.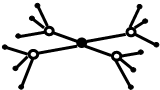 周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题:
周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大.X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子.回答下列问题: ,W基态原子的电子排布式为[Ar]3d104s1.
,W基态原子的电子排布式为[Ar]3d104s1.