题目内容
19.H、C、N、O、Na、Cr是常见的六种元素.(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
| 电负性 | 键长 | 键的极性 | 沸点(同压) |
| C<N | C=C<C-C | N-H<O-H | 甲醇>丁烷 |
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
分析 (1)C的原子序数为6,原子结构中有2个电子层,最外层电子数为4;Cr的原子核外有24个电子,分4层排布;根据乙炔的结构分析;
(2)同周期从左到右电负性增强;
键长越短,键能越大;
非金属性越强,键的极性越强;
分子间含有氢键时沸点较高;
(3)已知①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ•mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
由盖斯定律:2×①-②得Na(s)+Na2O2(s)=2Na2O(s)据此计算;
(4)乙醇与CrO3和少量H2SO4反应生成硫酸铬、二氧化碳和水.
解答 解:(1)C的原子序数为6,原子结构中有2个电子层,最外层电子数为4,C元素位于元素周期表第二周期,第IVA族;Cr的原子核外有24个电子,分4层排布,其电子排布式为:1s22s22p63s23p63d54s1;乙炔的结构为H-C≡C-H,单键中含有1个σ键,三键中含有1个σ键和2个π键,则分子中σ键与π键数目之比为 3:2;
故答案为:二;IVA;1s22s22p63s23p63d54s1;3:2;
(2)同周期从左到右电负性增强,则电负性:C<N;
键长越短,键能越大,双键的键能大于单键,则双键的键长小于单键;
非金属性O>S,则键的极性:N-H<O-H;
分子间含有氢键时沸点较高,甲醇分子间含有氢键,则沸点:甲醇>丁烷,
故答案为:<;<;<;>;
(3)已知①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ•mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
由盖斯定律:2×①-②得Na(s)+Na2O2(s)=2Na2O(s)△H=2×(-414)-(-511)=-317 kJ•mol-1;
故答案为:Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1;
(4)乙醇与CrO3和少量H2SO4反应生成硫酸铬、二氧化碳和水,其反应的化学方程式为:C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O;
故答案为:C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
点评 本题考查较综合,涉及电子排布式、元素周期表的结构及应用、元素非金属性的比较及应用、氢键、盖斯定律的应用等,注重高频考点的考查,题目难度中等.

| A. | 化学键 | B. | 中心原子杂化类型 | ||
| C. | 分子构型 | D. | 分子间作用力 |
①生成物的百分含量一定增加;②生成物的产量一定增加; ③反应物的转化率一定增大;
④反应物的浓度一定降低; ⑤正反应速率一定大于逆反应速率;⑥使用合适的催化剂.
| A. | ①② | B. | ②⑤ | C. | ②③⑤ | D. | ②③④⑤⑥ |
| A. | 72 | B. | 53 | C. | 19 | D. | 125 |
| A. | Fe2+、Mg2+、SO42-、NO3- | B. | Na+、Ag+、Br-、PO43- | ||
| C. | Ba2+、K+、SO32-、ClO- | D. | Al3+、NH4+、CO32-、Cl- |

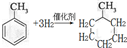 ,反应类型为加成反应.
,反应类型为加成反应. ,所得B的粗产品通常用重结晶的方法提纯.
,所得B的粗产品通常用重结晶的方法提纯.
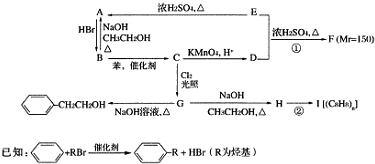
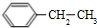 ,E、H中所含官能团的名称分别是羟基、碳碳双键.
,E、H中所含官能团的名称分别是羟基、碳碳双键.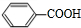 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$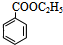 +H2O、n
+H2O、n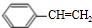 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$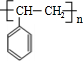 .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).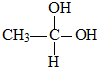 →CH3-CHO+H2O
→CH3-CHO+H2O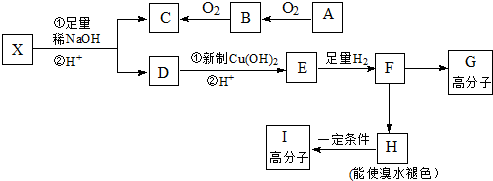
 .
. ;
;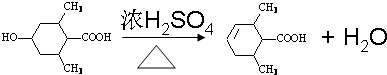 ;
; ;
; 任意一种.
任意一种.