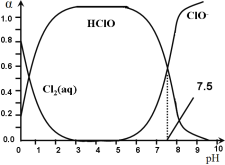
题目内容
【题目】已知甲酸的酸性强于醋酸。
(1)醋酸铵溶液呈中性,则甲酸铵溶液的pH____7(填“>”、“<”或“=”);若HCOONH4、NH4HSO4、NH4Cl三种溶液中的c(NH4+)相同,则c(HCOONH4)、c(NH4Cl)、c(NH4HSO4)的由大到小的顺序是_____________________________________。
(2)常温下0.01 mol·L-1 的氨水中![]() ,该溶液的pH为_________。向0.01 mol·L-1的甲酸溶液中逐滴加入0.01 mol·L-1的氨水,该过程中的离子浓度关系不可能为__________。
,该溶液的pH为_________。向0.01 mol·L-1的甲酸溶液中逐滴加入0.01 mol·L-1的氨水,该过程中的离子浓度关系不可能为__________。
A.c(HCOO-)>c(H+)>c(NH4+)>c(OH-) B.c(HCOO-)> c(NH4+)> c(H+) >c(OH-)
C.c(HCOO-)= c(NH4+) > c(H+) =c(OH-) D.c(HCOO-)> c(NH4+)>c(OH-)> c(H+)
E.c(NH4+)>c(HCOO-)> c(OH-)>c(H+)
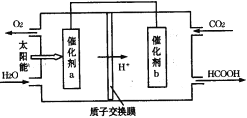
(3)如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂a附近的pH_______(填“增大”、“不变”或“减小”),催化剂b表面发生的电极反应式为___________________。
(4)常温下,0.02 mol·L-1的HCOONa溶液pH=8,则常温下HCOOH的电离常数Ka约为_____________。
【答案】< c(HCOONH4)>c(NH4Cl)> c(NH4HSO4) 10 D 减小 CO2+2H++2e-=HCOOH 2×10-4 (mol·L-1)
【解析】
(1)CH3COONH4溶液呈中性,说明水解程度:CH3COO-=NH4+,酸性:HCOOH>CH3COOH据此分析,根据HCOO-、H+对NH4+水解程度影响判断,c(NH4+)相同时三种铵盐浓度的大小;
(2)结合水的离子积常数计算;
分析氨水和甲酸反应各阶段溶质,溶液的酸碱性,结合电荷守恒、物料守恒判断;
(3)根据图知,a上水失电子生成氧气和氢离子;b上二氧化碳得电子和氢离子反应生成HCOOH;
(4)混合溶液的pH=8,分析溶液中c(H+)、c(OH-)、c(Na+)浓度,结合电荷守恒、物料守恒计算电离常数 。
(1)CH3COONH4溶液呈中性,说明水解程度:CH3COO-=NH4+,酸性:HCOOH>CH3COOH,则水解程度:HCOO-<NH4+,所以溶液呈酸性;HCOO-促进NH4+水解、H+抑制NH4+水解,NH4+水解程度越大,c(NH4+)相同的这三种铵盐浓度越大,所以c(NH4+)相同时,c(HCOONH4)、c(NH4Cl)、c(NH4HSO4)由大到小的顺序是c(HCOONH4)>c(NH4Cl)> c(NH4HSO4) ;
(2)常温下0.01 molL-1的氨水中![]() ,c(H+)×c(OH-)=1×10-14,则c(H+)=1×10-10,pH=-lgc(H+)=10;
,c(H+)×c(OH-)=1×10-14,则c(H+)=1×10-10,pH=-lgc(H+)=10;
A.氨水的量很少时,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(HCOO-)>c(NH4+),因为氨水的量很少,所以存在c(H+)>c(NH4+),则存在 c(HCOO-)>c(H+)>c(NH4+)>c(OH-),故A不符合题意;
B.当二者恰好完全反应时,甲酸铵溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(HCOO-)>c(NH4+),但是甲酸根离子和铵根离子水解程度都较小,所以存在c(HCOO-)>c(NH4+)>c(H+)>c(OH-),故B不符合题意;
C.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(HCOO-)=c(NH4+),水的电离程度较小,所以存在c(HCOO-)=c(NH4+)>c(H+)=c(OH-),故C不符合题意;
D.如果溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(NH4+)>c(HCOO-),所以不存在c(HCOO-)>c(NH4+)>c(OH-)>c(H+),故D符合题意;
E.如果溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(NH4+)>c(HCOO-),氨水的量小于甲酸铵,则存在c(NH4+)>c(HCOO-)>c(OH-)>c(H+),故E不符合题意;
(3)根据图知,a上水失电子生成氧气和氢离子,负极反应式为2H2O-4e-=O2↑+4H+,因为有氢离子生成导致溶液pH减小;b上二氧化碳得电子和氢离子反应生成HCOOH,电极反应式为CO2+2e-+2H+=HCOOH;
(4)混合溶液的pH=8,则溶液中c(H+)=1×10-8,溶液中c(OH-)=1×10-6,钠离子不水解则溶液中c(Na+)=0.02mol/L,根据电荷守恒得c(HCOO-)=c(Na+)+c(H+)-c(OH-)=(0.02+1×10-8-1×10-6)mol/L,根据物料守恒得c(HCOOH)=[0.02-(0.02+1×10-8-1×10-6)]mol/L=(1×10-6-1×10-8)mol/L,电离平衡常数![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)2NH3(g)△H=________kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H20.5mol,在一定温度下进行反应:N2(g)+3H2(g) 2NH3(g),达到平衡时,N2的转化率为![]() ,此时容器的体积为1L。
,此时容器的体积为1L。
该温度时容器中平衡体系的平衡常数是______________。
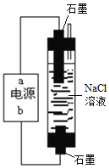
(3)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:
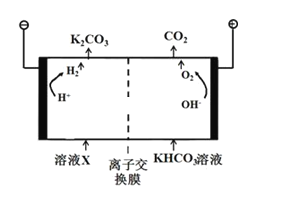
①在阳极区发生的反应包括____________________和H++HCO3- ═H2O+CO2↑。
②简述CO32-在阴极区再生的原理__________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)═2H2O(g) Δ H1═-484kJ/mol
2CH3OH(g)+ 3O2(g)═2CO2(g)+4H2O(g) Δ H2═-1352kJ/mol
写出CO2和H2生成CH3OH(g)和H2O(g)的热化学方程式__________。