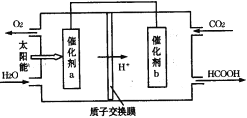
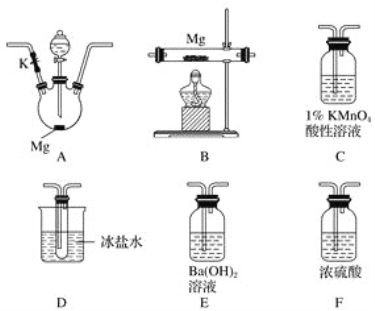
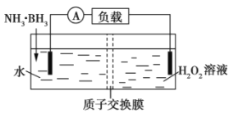
题目内容
【题目】氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2==2Fe(SCN)3、Ag++CN-== AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2= 2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (SCN)2+H2O = 2H++SCN-+SCNO-
D. MnO2+4HSCN(浓)![]() (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
【答案】C
【解析】
根据题意“(CN)2、(SCN)2与卤素单质的性质相似”,可知拟卤素能与水、碱反应,由“2Fe+3(SCN)2=2Fe(SCN)3”,拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,则在溶液中主要以分子形式存在,阴离子的还原性一般比Br-弱,则不能被溴氧化而能被氯气氧化,据此分析。
A.阴离子的还原性一般比Br-弱,说明不能被溴氧化而能被氯气氧化,所以2CN-+Cl2═2Cl-+(CN)2,故A正确;
B.(CN)2与卤素单质的性质相似,可以发生类似氯气与碱的反应,与碱发生反应(CN)2+2OH-=CN-+CNO-+H2O,故B正确;
C.卤素单质能与水反应,(SCN)2与卤素单质的性质相似,则与水反应,发生(SCN)2+H2O ![]() HSCN+HSCNO,拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,所以在溶液中主要以分子形式存在,不能拆成离子,故C错误;
HSCN+HSCNO,拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,所以在溶液中主要以分子形式存在,不能拆成离子,故C错误;
D.MnO2与浓盐酸反应生成氯气,(SCN)2与卤素单质的性质相似,则HSCN与MnO2反应生成(SCN)2,反应的方程式为MnO2+4HSCN![]() Mn(SCN)2+(SCN)2↑+2H2O,故D正确;
Mn(SCN)2+(SCN)2↑+2H2O,故D正确;
答案为C。

【题目】某班同学用以下实验探究![]() 、
、![]() 的性质。回答下列问题:
的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁、溴化亚铁固体,均配制成![]() 的溶液。在
的溶液。在![]() 溶液中需加入少量铁屑,其目的是_____________________________________。
溶液中需加入少量铁屑,其目的是_____________________________________。
(2)甲组同学取![]() 溶液,加入几滴氯水,再加入1滴
溶液,加入几滴氯水,再加入1滴![]() 溶液,溶液变红,说明
溶液,溶液变红,说明![]() 可将
可将![]() 氧化。
氧化。![]() 溶液与氯水反应的离子方程式为____________________。
溶液与氯水反应的离子方程式为____________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在![]() 溶液中先加入
溶液中先加入![]() 煤油,再向下层溶液中依次加入几滴氯水和1滴
煤油,再向下层溶液中依次加入几滴氯水和1滴![]() 溶液,溶液变红。煤油的作用是_________________________。
溶液,溶液变红。煤油的作用是_________________________。
(4)丙组同学取![]() 上述
上述![]() 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:![]() 被
被![]() 氧化成
氧化成![]() 溶解在溶液中;
溶解在溶液中;
假设2:![]() 被
被![]() 氧化成
氧化成![]() 。
。
请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入____________,振荡、静置现象:____________ | 假设1正确 |
②向溶液中加入____________,现象:____________ | 假设2正确 |
(5)已知:![]() 。若在
。若在![]() 上述
上述![]() 溶液中通入标准状况
溶液中通入标准状况![]() ,反应的离子方程式为________________________________。
,反应的离子方程式为________________________________。