题目内容
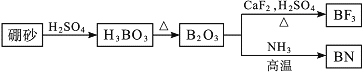
【题目】新型陶瓷材料氮化硅(Si3N4)可用于制作火箭发动机中燃料的喷嘴。氮化硅可由石英、焦炭在高温氮气流中制取。完成下列填空:______SiO2+______C+______N2![]() ______Si3N4+______CO。
______Si3N4+______CO。
(1)试配平该化学反应方程式,将系数填写在对应位置上。在方程式上标出电子转移的方向和数目。____________
(2)反应中______被还原,当氧化产物比还原产物多 1mol 时,反应中电子转移数为______。
(3)在该反应体系中:所涉及物质属于非极性分子的电子式为______;所涉及元素中原子半径最大的原子的最外层电子排布式为______。
(4)反应的主要产物氮化硅所属的晶体类型为______,证明氮化硅组成元素非金属性强弱:
(Ⅰ)写出一个化学事实______;
(Ⅱ)从原子结构上进行说明:______。
【答案】![]() N2 2.4NA
N2 2.4NA ![]() 3s23p2 原子晶体 HNO3为强酸,H2SiO3为弱酸(或Si3N4中Si为+4价、N为-3价等) 相对原子半径小的N原子最外层有5个电子,形成稳定结构得3个电子,相对原子半径大的Si原子最外层有4个电子,形成稳定结构要得4个电子,得电子形成稳定结构时Si比N更难
3s23p2 原子晶体 HNO3为强酸,H2SiO3为弱酸(或Si3N4中Si为+4价、N为-3价等) 相对原子半径小的N原子最外层有5个电子,形成稳定结构得3个电子,相对原子半径大的Si原子最外层有4个电子,形成稳定结构要得4个电子,得电子形成稳定结构时Si比N更难
【解析】
(1)由产物CO可知,SiO2与C化学计量数之比为1:2。由产物Si3N4可知SiO2与N2化学计量数之比为3:2,所以SiO2、C、N2化学计量数之比为3:6:2,令SiO2的化学计量数为3,C、N2化学计量数分别为6、2,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2+6C+2N2 Si3N4+6CO,其中N的化合价降低,则N2发生得电子的还原反应,C发生失电子的氧化反应,反应中共转移12e-,电子转移的方向和数目为
Si3N4+6CO,其中N的化合价降低,则N2发生得电子的还原反应,C发生失电子的氧化反应,反应中共转移12e-,电子转移的方向和数目为![]() ;
;
(2)反应3SiO2+6C+2N2 Si3N4+6CO中N元素化合价降低,N2发生还原反应,Si3N4为还原产物、CO为氧化产物,生成6molCO和1molSi3N4时,共转移12mole-,所以当氧化产物比还原产物多1mol时,反应中转移
Si3N4+6CO中N元素化合价降低,N2发生还原反应,Si3N4为还原产物、CO为氧化产物,生成6molCO和1molSi3N4时,共转移12mole-,所以当氧化产物比还原产物多1mol时,反应中转移![]() =2.4mol电子,即转移电子数电子数为2.4NA;
=2.4mol电子,即转移电子数电子数为2.4NA;
(3)反应3SiO2+6C+2N2 Si3N4+6CO中,N2为非极性分子,结构式为N≡N,电子式为
Si3N4+6CO中,N2为非极性分子,结构式为N≡N,电子式为![]() ,Si的原子半径最大,最外层电子的4个电子排布于3s、3p能级上,即排布式为3s23p2;
,Si的原子半径最大,最外层电子的4个电子排布于3s、3p能级上,即排布式为3s23p2;
(4)氮化硅(Si3N4)是共价化合物,可用于制作火箭发动机中燃料的喷嘴,说明其熔点高,所以氮化硅为原子晶体;
(I)比较N、Si非金属性强弱,可根据元素的最高价含氧酸的酸性强弱判断,酸性越强,则元素的非金属性越强,即它们的最高价氧化物对应水化物中,HNO3为强酸,H2SiO3为弱酸;
(Ⅱ)由于N原子半径小,Si原子半径大,形成稳定结构时N得电子的能力强,即得电子能力强的N原子的非金属性强于Si,导致Si3N4中Si为+4价、N为-3价。

【题目】25℃时,电离平衡常数如下表,下列说法错误的是
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
A.离子结合质子的能力由大到小的顺序是:CO32- > ClO- > HCO3- > CH3COO-
B.2ClO-+CO2+H2O=CO32-+2HClO反应不能发生
C.用蒸馏水稀释0.10mol·L-1的醋酸,c(CH3COO-)/c(CH3COOH)的数值逐渐增大
D.等体积、等pH的CH3COOH与HClO两溶液与NaOH恰好完全反应,CH3COOH消耗氢氧化钠物质的量更多
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中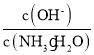 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)