题目内容
已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
(1)减小(2)CH3COO— + H2O CH3COOH+OH-;增大(3)小于;大于(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)(5)小于(6)BC(7)Cd2+、Zn2+;[OH-]=2.2×10-5mol·L-1 [M2+][OH-]2=5×10-12(mol·L-1)35×10-12小于KSP[Mg(OH)2]=1.8×10-115×10-12大于KSP[Zn(OH)2]=1.2×10-175×10-12大于KSP[Cd(OH)2]=2.5×10-14(8)1×10-12
CH3COOH+OH-;增大(3)小于;大于(4)c(Na+)>c(CH3COO-)>c(OH-)>c(H+)(5)小于(6)BC(7)Cd2+、Zn2+;[OH-]=2.2×10-5mol·L-1 [M2+][OH-]2=5×10-12(mol·L-1)35×10-12小于KSP[Mg(OH)2]=1.8×10-115×10-12大于KSP[Zn(OH)2]=1.2×10-175×10-12大于KSP[Cd(OH)2]=2.5×10-14(8)1×10-12
解析试题分析:(1)因醋酸钠固体电离产生CH3COO-,c(CH3COO-)增大,使的平衡CH3COOH?CH3COO-+H+逆向移动,C(H+)减小,C(CH3COOH)增大,所以C(H+)与C(CH3COOH)的比值减小,故答案为:减小;(2)醋酸钠水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,该反应是吸热反应,温度升高,溶液中氢氧根离子浓度增大,故答案为:CH3COO-+H2O?CH3COOH+OH-;增大;(3)由于醋酸钠溶液中,醋酸钠的浓度越大,水解程度越小,但是溶液中的氢氧根离子的物质的量浓度反而越大,溶液的PH越大,所以m小于n,a大于b,故答案为:小于;大于;(4)醋酸为弱电解质,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好生成CH3COONa,为强碱弱酸盐,溶液呈碱性,c(OH-)>c(H+),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)>c(CH3COO-),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);(5)由于溶液的PH小于7,溶液中氢离子物质的量浓度大于氢氧根离子的浓度,氢离子主要是醋酸电离的,所以醋酸根离子浓度大于钠离子浓度,故答案为:小于;(6)A、若反应后溶液呈中性,溶液中氢离子浓度=氢氧根离子浓度=1×10-7mol?L-1c(H+)+c(OH-)=2×10-7mol?L-1,故A说法正确;B、醋酸是弱电解质部分电离,醋酸的浓度大于氢氧化钠的浓度,若V1=V2,反应后溶液pH一定小于7,故B说法错误;C、若反应后溶液呈酸性,由于醋酸浓度大于氢氧化钠浓度,则V1≤V2,故C说法错误;D、若反应后溶液呈碱性,由于V1=V2溶液显示酸性,所以V1一定小于V2,故D说法正确;(7)溶液中氢氧根离子浓度是:[OH-]=2.2×10-5mol?L-1,根据[M2+][OH-]2=5×10-12(mol?L-1)3,由于5×10-12小于KSP[M(OH)2]=1.8×10-11,没有氢氧化镁沉淀生成,由于5×10-12大于KSP[Zn(OH)2]=1.2×10-17,有氢氧化锌淀生成,由于5×10-12大于KSP[Cd(OH)2]=2.5×10-14,有Cd(OH)2沉淀生成,故答案为:Cd2+、Zn2+;(8)稀释后溶液中的氢离子浓度是:c(H+)=0.5mol?L?1×0.01L/0.5L=0.01mol/L,由于盐酸溶液中,水电离的氢离子浓度等于溶液中的氢氧根离子的浓度,该溶液中由水电离出的c(H+)=1×10-12,故答案为:1×10-12.
考点:弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质;酸碱混合时的定性判断及有关pH的计算。

下表是不同温度下水的离子积的数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________________________________________。
(2)25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在t2温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a∶b=________。
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| NH3·H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)____________mol/L。
(2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为________。
(3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______性,0.1mol/LNH4HCO3溶液中物质的量浓度最大的离子是_________(填化学式)。
(4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。
(5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式______________。
某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。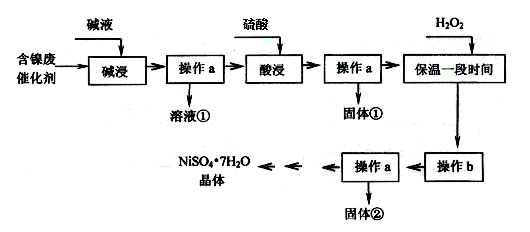
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 4.1 | 1.7 | 7.6 | 7.0 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.5 | 9.2 |
(1)操作a为 。
(2)“碱浸”的目的是除去 (填化学式)。
(3)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(4)NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH。
①写出该反应的离子方程式 。
②已知碱性镍氢电池总反应: H2+2NiOOH
 2Ni(OH)2,写出该反应放电时正极反应式 。
2Ni(OH)2,写出该反应放电时正极反应式 。(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积
 。
。 硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中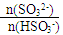 随pH变化的关系:
随pH变化的关系:
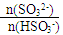 | 91:9 | 1:1 | 9:91 |
| 室温下pH | 8.2 | 7.2 | 6.2 |
(1)简述
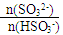 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则c (HSO3-) + 2c (SO32-) =" _______" mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式: 。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62-……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
请回答:
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)