题目内容
下表是不同温度下水的离子积的数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________________________________________。
(2)25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在t2温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a∶b=________。
(1)> 温度升高,水的电离程度增大,离子积增大 (2)1 000∶1
(3)碱 9∶11
解析

 备战中考寒假系列答案
备战中考寒假系列答案已知25°C时:
| 电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积 | 1.8×10-11 | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | 9.7 | 5.0 | 5.5 | 4.0 |
在物质的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。例如:
①为了除去氯化铵晶体中的氯化铁杂质,先将混合物溶于水,再加入一定量的试剂a进行反应,过滤结晶即可;
②为了除去氯化镁晶体中的氯化铁杂质,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的硫酸亚铁杂质,先将混合物溶于水,再加入一定量的双氧水,将亚铁离子氧化,然后加入试剂b调节溶液的pH=4,过滤结晶即可。
(1)上述三种除杂方案都将Fe2+、Fe3+转化为________(填化学式)而除去。
(2)试剂a为________。
(3)写出②中除杂所发生的总反应的离子方程式:________。
(4)下列与方案③有关的叙述正确的是________(填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引入杂质,不产生污染
B.将亚铁离子氧化的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4的试剂b是氢氧化铜或氧化铜
D.在pH大于4的溶液中Fe3+已完全不存在
如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。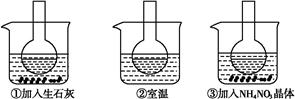
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
| A.水解反应为放热反应 | B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 | D.NH4NO3溶于水时吸收热量 |
已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
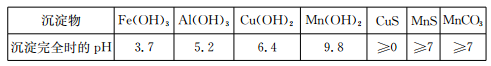
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下: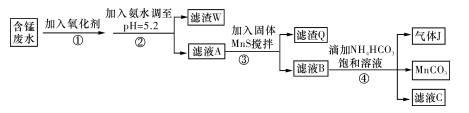
 H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题: