题目内容
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH_____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4) 下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(5) 25℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)。
(1)13 (2)< NH4++H2O NH3·H2O+H+ (3)C (4) D (5) <
NH3·H2O+H+ (3)C (4) D (5) <
解析试题分析:(1)氢氧化钠是一元强碱,则25 ℃时,0.1 mol·L-1NaOH溶液中OH-浓度是0.1mol/L,所以溶液中氢离子浓度=10-14÷0.1=10-13mol/,因此溶液的pH为13。
(2)由于氯化铵是强酸弱碱盐,溶于水NH4+水解,NH4++H2O NH3·H2O+H+,溶液显酸性,则25 ℃时,0.1 mol·L-1NH4Cl溶液的pH<7。
NH3·H2O+H+,溶液显酸性,则25 ℃时,0.1 mol·L-1NH4Cl溶液的pH<7。
(3))25 ℃时,0.1 mol·L-1NaOH溶液与0.1 mol·L-1NH4Cl溶液等体积混合后,二者恰好反应生成氯化钠和弱电解质一水合氨,溶液显碱性,因此溶液中离子浓度大小关系是[Na+]=[Cl-]>[OH-]>[H+],答案选C。
(4)溶于水或在熔融状态下能够电离出离子的化合物是电解质,溶于水和在熔融状态下都不能电离出离子的化合物是非电解质,据此可以判断。A、铁是金属单质,可以导电,但不是电解质,也不是非电解质,A不正确;B、盐酸可以导电,但属于混合物,不是电解质,也不是非电解质,B不正确;C、氯化钠晶体是电解质,但不能导电,只有溶于水或在熔融状态下才能导电,C不正确;D、熔融的氢氧化钠可以导电,属于电解质,D正确,答案选D。
(5)水是弱电解质,存在电离平衡H2O H++OH-。因此酸或碱抑制水的电离,盐类水解促进水的电离。0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1<C2。
H++OH-。因此酸或碱抑制水的电离,盐类水解促进水的电离。0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1<C2。
考点:考查pH计算、弱电解质的电离、盐类水解、电解质与导电性判断以及溶液中离子浓度大小比较

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
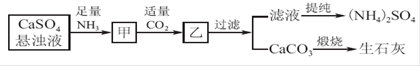
 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。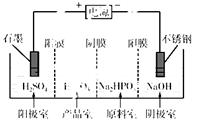
 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
 SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。