题目内容
16.除去如表物质中所含杂质(括号内为杂质),选用的试剂或分离方法正确的是( )| 混合物 | 试剂 | 分离方法 | |
| A | Fe(碘) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、加热条件下,铁与碘反应;
B、二氧化碳也能溶于碳酸钠;
C、乙酸能和NaOH溶液反应,乙酸乙酯也能在NaOH溶液中水解;
D、淀粉相对分子质量较大,溶于水形成胶体.NaCl溶于水形成溶液,渗析可分离溶液和胶体.
解答 解:A、由于加热条件下,铁粉与碘能反应,故A错误;
B、二氧化碳也能溶于碳酸钠,正确除杂试剂是碳酸氢钠,故B错误;
C、NaOH溶液会使乙酸乙酯水解成乙酸和乙醇,故C错误;
D、淀粉相对分子质量较大,溶于水形成胶体.NaCl溶于水形成溶液,渗析可分离溶液和胶体,故D正确;
故选D.
点评 本题主要考查的是常见物质的分类与除杂方法,容易出错的是A选项,同学们想到了碘易升华,但是未注意两者能反应,有一定的难度.

练习册系列答案
相关题目
10.25℃时,弱酸的电离平衡常数如下表,下列叙述不正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等体积、等物质的量浓度的CH3COOH溶液和Na2CO3溶液反应后的溶液呈碱性 | |
| B. | a mol/LHCN溶液与bmol/LNaOH溶液等体积混合,所得溶液c(Na+)>c(CN- ),则a可能等于b | |
| C. | 相同温度时,等物质的量浓度三种溶液的PH关系:NaCN>Na2CO3>CH3COONa | |
| D. | 向NaCN溶液中通入少量的CO2离子方程式为:CN-+H2O+CO2=HCN+HCO3- |
11.下列说法正确的是( )
| A. | 已知X在一定条件下转化为Y,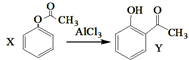 ,X与Y互为同系物,可用FeBr3溶液鉴别 ,X与Y互为同系物,可用FeBr3溶液鉴别 | |
| B. |  能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物有5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
11.能够鉴定氯乙烷中氯元素的存在的操作是( )
| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热,然后加入AgNO3溶液 | |
| D. | 加入热的NaOH醇溶液,充分反应后,加入稀硝酸酸化,再加入AgNO3溶液 |
8.常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( )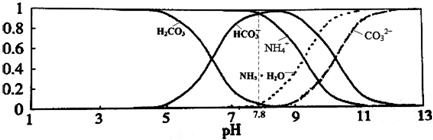

| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
5.下列说法不正确的是( )
| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
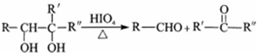
 +2H2O.
+2H2O.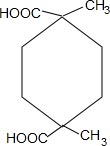 .
.
 ]2-Na+
]2-Na+