题目内容
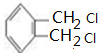
11.能够鉴定氯乙烷中氯元素的存在的操作是( )| A. | 在氯乙烷中直接加入AgNO3溶液 | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热,然后加入AgNO3溶液 | |
| D. | 加入热的NaOH醇溶液,充分反应后,加入稀硝酸酸化,再加入AgNO3溶液 |
分析 检验氯乙烷中氯元素先使氯乙烷中的氯原子变为氯离子,氯乙烷可以在氢氧化钠水溶液中水解生成氯离子,也可以在氢氧化钠醇溶液中发生消去反应生成氯离子,最后加入硝酸酸化,加入硝酸银,观察是否有白色沉淀生成,以此解答.
解答 解:A.在氯乙烷中直接加入AgNO3溶液,不发生反应,不能鉴别,故A错误;
B.在氯乙烷中加蒸馏水,然后加入AgNO3溶液,不发生反应,不能鉴别,故B错误;
C.加入NaOH溶液,加热,发生水解,然后加入AgNO3溶液,因没有酸化,不能排出AgOH的干扰,故C错误;
D.在氯乙烷中加入NaOH溶液,加热,发生水解生成NaCl,冷却后酸化,然后加入AgNO3溶液,生成白色沉淀可鉴别,故D正确;
故选D.
点评 本题考查氯代烃中的元素的检验,为基础性习题,把握卤代烃的水解、消去反应为解答的关键,注意必须先加稀硝酸酸化,再根据是否产生白色沉淀来确定是否存在氯元素,题目难度不大.

练习册系列答案
相关题目
5.下列叙述正确的是( )
| A. | Na、C、P、S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3 | |
| B. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓疏酸都能使铁、铝钝化 | |
| C. | 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中 | |
| D. | 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质 |
6.运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
①30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ad (填字母编号).
a.通入一定量的NO b.加入一定量的活性炭 c.加入合适的催化剂 d.适当缩小容器的体积
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如1图所示,利用以下反应:NO+CO?N2+CO2(有CO),2NO?N2+O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出C2H6与NO2发生反应的化学方程式4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O.
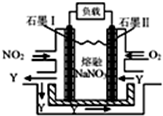
③以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为NO2+NO3--e-=N2O5.
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).
①在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强P1小于 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”).
②天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图3,则X的结构简式为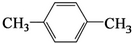 .
.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
a.通入一定量的NO b.加入一定量的活性炭 c.加入合适的催化剂 d.适当缩小容器的体积
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如1图所示,利用以下反应:NO+CO?N2+CO2(有CO),2NO?N2+O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出C2H6与NO2发生反应的化学方程式4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O.
③以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为NO2+NO3--e-=N2O5.

(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).
①在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强P1小于 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”).
②天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图3,则X的结构简式为
 .
.
16.除去如表物质中所含杂质(括号内为杂质),选用的试剂或分离方法正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | Fe(碘) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
3.25℃下,几种酸的电离平衡常数如表所示,则相关说法不正确的是( )
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数 | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | pH相同的氯水和亚硝酸溶液中水电离的c(H+)相同 | |
| B. | 向氯水中滴加氢氧化钠溶液至中性:c(Na+)=2 c(ClO-)+c(HClO) | |
| C. | 向漂白粉溶液中滴加H2SO3溶液可增强其漂白能力 | |
| D. | pH相同的醋酸钠、次氯酸钠和亚硝酸钠溶液中,c(Na+)最大的是亚硝酸钠 |
1.下列物质中只含有共价键的是( )
| A. | H202 | B. | NaCl | C. | NH4CI | D. | AI2O3 |
 .
. 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: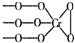 ,则Cr的化合价为+5.
,则Cr的化合价为+5.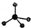 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为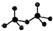 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
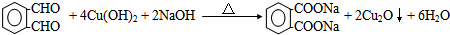
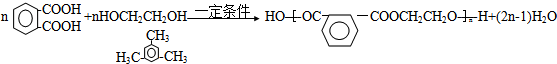
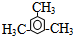 .
.