题目内容
5.下列说法不正确的是( )| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
分析 A.25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,溶液中的溶质为醋酸钠、醋酸,如果醋酸浓度远远大于醋酸钠,可能存在c(H+)>c(Na+);
B.反应速率与氢离子浓度成正比;
C.25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,说明抑制水电离,溶液中的溶质可能是酸或碱;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:A.25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,溶液中的溶质为醋酸钠、醋酸,如果醋酸浓度远远大于醋酸钠,可能存在c(H+)>c(Na+),结合电荷守恒得c(CH3COO-)>c(H+),所以可能存在离子浓度大小顺序是c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故A正确;
B.反应速率与氢离子浓度成正比,氢离子浓度相等的醋酸和盐酸,反应过程中醋酸继续电离出氢离子,而导致醋酸中氢离子浓度大于盐酸,所以醋酸反应速率较快,故B正确;
C.25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,说明抑制水电离,溶液中的溶质可能是酸或碱,如果溶液为酸液,则溶液的pH为14-a,如果溶液为碱液,溶液的pH=a,故C错误;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故D正确;
故选C.
点评 本题考查离子浓度大小比较、弱电解质的电离等知识点,为高频考点,侧重考查学生分析推断能力,结合电荷守恒、物料守恒判断,易错选项是BC,注意反应速率与离子浓度有关,与电解质强弱无关.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
19.栀子花具有浓郁的香味是因为栀子酯,其结构简式如图,下列说法正确的是( )
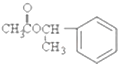

| A. | 该栀子酯的分子式C10H11O2 | |
| B. | 1mol栀子酯水解需要消耗2mol NaOH | |
| C. | 栀子酯可以发生加成、取代和消去反应 | |
| D. | 栀子酯的一氯代物有六种 |
16.除去如表物质中所含杂质(括号内为杂质),选用的试剂或分离方法正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | Fe(碘) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关化学实验原理、现象或结论的描述不正确的是( )
| A. | 用CoCl2溶液浸泡过的棉花制成简易湿度计,悬挂在家中,以粗略估计空气的湿度 | |
| B. | 在1mL0.5mol/L的AlCl3溶液中加入2mL饱和的NaF溶液,再加入1mL3.mol/L的氨水,整个过程都无明显现象 | |
| C. | 向1mL1%的NaOH溶液中加入2ml2%的CuSO4溶液,振荡后再加入0.5mL有机物X,溶液呈现绛蓝色,则X是甘油 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏高 |
17.在大型演唱晚会上,观众经常使用荧光棒来增添喜庆气氛.荧光棒内草酸二苯酯和过氧化氢反应导致发光的原理大致如下:①草酸二苯酯+H2O2→C2O4+2C6H5OH;②生成的中间产物把能量传递给染料:C2O4+染料→染料*(电子激发态)+2CO2,电子激发态的染料不稳定,借发光而回到基态.下列说法不正确的是( )
| A. | 草酸二苯酯的分子式是C14H10O4 | |
| B. | 上述变化证明化学能可以转化为光能 | |
| C. | C2O4的结构简式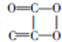 | |
| D. | 反应①属于酯水解反应 |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.8g重水中含有的电子数为NA | |
| B. | 1L0.1mol/L FeCl3溶液中含有的Cl- 数为0.3NA | |
| C. | 25℃,1L pH=13的Ba(OH)2溶液中含有的oH-数为0.2NA | |
| D. | 标准状况下,2.24L NO和NO2混合气体中含有的氧原子数为0.15NA |
15.取某一元醇13.00g跟乙酸混合后,加入浓硫酸并加热,若反应完毕时,制得乙酸某酯15.80g,回收该一元醇1.40g.则该一元醇是( )
| A. | C7H15OH | B. | C6H13OH | C. | C5H12OH | D. | C2H5OH |



 .
.