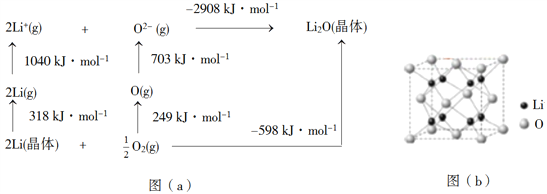
题目内容
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
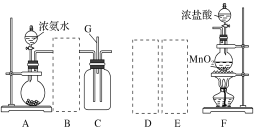
请回答下列问题:
(1)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
B:________、D:________、E:________。
(3)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:_______
(4)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:________________
【答案】ACE Ⅱ Ⅲ Ⅰ 8NH3+ 3Cl2 = N2+ 6NH4Cl 取适量固体于试管并溶解,加入氢氧化钠固体,然后加热试管,将润湿的红色石蕊试纸放在试管口,如果试纸变蓝,则证明有铵根离子。(或者取适量固体于试管并溶解,加入氢氧化钠固体,然后加热试管,将蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明有铵根离子)
【解析】
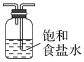
A为氨气的制备装置,和HCl反应前需要干燥,氨气为碱性气体可用碱性干燥剂干燥;F装置为氯气的制备装置,和氨气反应前需要除去混有的HCl气体并进行干燥,可以饱和食盐水除去HCl,然后用浓硫酸干燥;之后在C装置中进行反应。
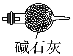
(1)该装置利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、C.生石灰、E烧碱都是碱性物质,且溶解于水时放出热量,D五氧化二磷、B浓硫酸虽然溶于水时放热,但是酸性物质,所以选A、C、E;
(2)B装置为干燥氨气的装置,氨气为碱性气体,可以用碱石灰干燥,所以选Ⅱ;氯气和氨气反应前需要除去混有的HCl气体并进行干燥,可以饱和食盐水除去HCl,然后用浓硫酸干燥,所以D选Ⅲ,E选Ⅰ;
(3)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,根据元素守恒可和电子守恒可得化学方程式为:8NH3+3Cl2=6NH4Cl+N2;
(4)根据氯气和氨气的反应可知该白色固体应为氯化铵,铵根可以和热碱反应生成氨气,据此可以检验铵根,具体操作为:取适量固体于试管并溶解,加入氢氧化钠固体,然后加热试管,将润湿的红色石蕊试纸放在试管口,如果试纸变蓝,则证明有铵根离子;或者取适量固体于试管并溶解,加入氢氧化钠固体,然后加热试管,将蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明有铵根离子。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下面是元素周期表的一部分。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | A | |||||||
二 | D | J | L | |||||
三 | B | C | E | G |
根据以上元素在周期表中的位置,用元素符号或化学式填写空白。
(1)非金属性最强的元素是_____________;化学性质最不活泼的是__________;除L外,原子半价最大的是____________;A与D形成的10电子离子是_____________。/span>
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式排列:___________。
(3)B元素与氧形成的既含有离子键,又含共价键的化合物的电子式为____________。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________________。
【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
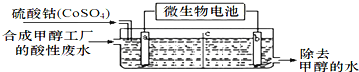
①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。