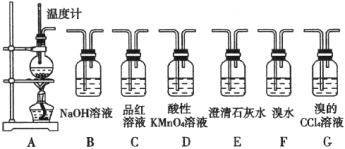
题目内容
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g)﹣236kJ
(1)反应涉及的元素原子半径从大到小的排列顺序为_____。其中硅原子最外层有_____个未成对电子,有_____种不同运动状态的电子;
(2)反应涉及的化合物中,写出属于非极性分子的结构式:_____;产物中晶体硅的熔点远高HCl,原因是_____;
(3)氯和硫是同一周期元素,写出一个能比较氯和硫非金属性强弱的化学方程式:_____;
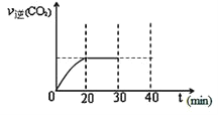
(4)在一定温度下进行上述反应,若反应容器的容积为2L,3分钟后达到平衡,测得气体质量减小8.4g,则在3分钟内H2的平均反应速率为_____;
(5)该反应的平衡常数表达式K=_____,可以通过_____使K增大;
(6)一定条件下,在密闭恒容器中,能表示上述反应一定达到化学平衡状态的是_____。
a.v逆(SiCl4)=2v正(H2)
b.固体质量保持不变
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
【答案】Si>Cl>H 2 14 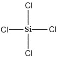 、H-H Si是原子晶体而HCl是分子晶体 H2S+Cl2=S↓+2HCl 0.1mol/(L.min)
、H-H Si是原子晶体而HCl是分子晶体 H2S+Cl2=S↓+2HCl 0.1mol/(L.min) 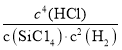 升高温度 bc
升高温度 bc
【解析】
⑴ 反应涉及的原子有Si、Cl、H,根据电子层数越多半径越大,电子层数相同,原子序数越大半径越小得出半径大小关系:Si>Cl>H;Si原子最外层有4个电子,最外层电子排布式为:3s23p2,p轨道有2个未成对电子;Si原子核外共有14个电子,所以就有14种不同运动状态的电子,故答案为:Si>Cl>H;2;14;
⑵SiCl4为正四面体结构是非极性分子,其结构式为:  ,H2是双原子形成的单子分子,也是非极性分子,其结构式为H-H;产物中硅是原子晶体,HCl形成的是分子晶体,故晶体硅的熔点远高HCl固体的熔点,故答案为:
,H2是双原子形成的单子分子,也是非极性分子,其结构式为H-H;产物中硅是原子晶体,HCl形成的是分子晶体,故晶体硅的熔点远高HCl固体的熔点,故答案为: 、H-H;Si是原子晶体而HCl是分子晶体;
、H-H;Si是原子晶体而HCl是分子晶体;
⑶ 非金属性强的非金属单质可以从溶液中置换出非金属性弱的非金属单质,化学反应方程式:H2S+Cl2 = 2HCl + 2S↓,故答案为:H2S+Cl2 = 2HCl + 2S↓;
⑷ 根据化学反应方程式SiCl4(g)+2H2(g)Si(s)+4HCl(g)减轻的质量是生成硅的质量,所以生成硅的物质的量n(Si)= ![]() ,根据n(H2):n(Si) =2:1 得出n(H2) = 0.6 mol,再根据化学反应速率公式得出
,根据n(H2):n(Si) =2:1 得出n(H2) = 0.6 mol,再根据化学反应速率公式得出![]() ,故答案为:0.1mol/(Lmin);
,故答案为:0.1mol/(Lmin);
⑸平衡常数表达式等于生成物平衡浓度幂之积比上反应物平衡浓度幂之积,此反应K=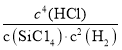 ,反应为吸热反应,升温可以使平衡右移,生成物平衡浓度增大,反应物浓度减小,故K增大;故答案为:
,反应为吸热反应,升温可以使平衡右移,生成物平衡浓度增大,反应物浓度减小,故K增大;故答案为: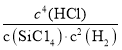 ;升高温度;
;升高温度;
(6)a.v逆(SiCl4)=2v正(H2),说明正逆反应速率不相等,反应未达到平衡状态,故a错误;
b.只有达到平衡时,固体质量才为一定值,未达平衡时一直在变化,故固体质量保持不变说明反应达到平衡状态,故b正确;
c.根据质量守恒定律可知固体质量与气体总质量之和为一定值,只有达到平衡时,气体质量才为一定值,未达平衡时一直在变化,由于容积固定,所以混合气体密度保持不变说明反应达到平衡状态,故c正确;
d.c(SiCl4)、c(H2)和c(HCl)的初始浓度未知,变化量也未知,所以当c(SiCl4):c(H2):c(HCl)=1:2:4时不一定为化学平衡状态,故d错误;
故答案为:bc。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)CO(g)+H2(g)△H=+131.4kJmol-1,下列判断正确的是_______。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)C(s)+H2O(1)△H=﹣QkJmol-1,则Q<131.4
d.若C(s)+CO2(g)2CO(g)△H1;CO(g)+H2O(g)H2(g)+CO2(g)△H2则:△H1+△H2=+131.4kJmol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如表:
不同时间各物质的物质的量/mol | ||||
0min | 2min | 4min | 6min | |
CH4 | 2.00 | 1.76 | 1.60 | n2 |
H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0min~2min 内H2的平均反应速率为_____________________。
②达平衡时,CH4的转化率为_____________;在上述平衡体系中再充入2.00mol甲烷1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___________(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有__________(填字母)。
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3υ正(CH4)=υ逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过):
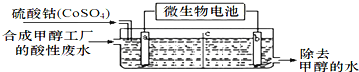
①a电极的名称为__________。
②写出除去甲醇的离子方程式______________________。
③微生物电池是绿色酸性料电池,写出该电池正极的电极反应式为__________________。