题目内容
3.已知Fe2(SO4)3的物质的量浓度为3mol/L,写出Fe2(SO4)3的电离方程式,并求Fe3+和SO42-的物质的量浓度.分析 硫酸铁为强电解质,完全电离生成三价铁离子与硫酸根离子;
依据硫酸铁电离方程式可知:1mol硫酸铁电离产生2mol三价铁离子和3mol硫酸根离子,据此计算三价铁离子与硫酸根离子浓度.
解答 解:硫酸铁为强电解质,完全电离生成三价铁离子与硫酸根离子,电离方程式:Fe2(SO4)3=2Fe3++3SO42-,
由硫酸铁电离方程式Fe2(SO4)3=2Fe3++3SO42-,可知1mol硫酸铁电离产生2mol三价铁离子和3mol硫酸根离子,所以硫酸铁溶液中c(Fe3+)=2c(Fe2(SO4)3)=2×3mol/L=6mol/L;
硫酸铁溶液中c(SO42-)=3c(Fe2(SO4)3)=3×3mol/L=9mol/L;
答:电离方程式为Fe2(SO4)3=2Fe3++3SO42-;c(Fe3+)=6mol/L、c(SO42-)=9mol/L.
点评 本题考查了电解质电离方程式书写及溶液中离子浓度计算,明确电解质强弱是解题关键,题目难度不大.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
1. 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(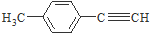 )的一条路线如下:
)的一条路线如下:
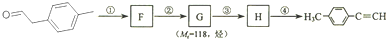
(1)对甲基苯乙醛的分子式为:C9H10O;
(2)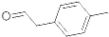 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个;
 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;
(3)写出①--④步反应所加试剂、反应条件和①--③步反应类型:
 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔( )的一条路线如下:
)的一条路线如下:
(1)对甲基苯乙醛的分子式为:C9H10O;
(2)
 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个; 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;(3)写出①--④步反应所加试剂、反应条件和①--③步反应类型:
| 序号 | 所加试剂及反应条件 | 反应类型 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
18.同一周期三种非金属元素X、Y、Z,其最高价氧化物的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4.下列说法正确的是( )
| A. | 元素的非金属性:X<Y<Z | B. | X、Y、Z依次位于ⅤA族、ⅥA族、ⅦA族 | ||
| C. | 阴离子的还原性:X->Y2->Z3- | D. | 气态氢化物的稳定性:HX>H2Y>ZH3 |
8.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-=Cu(OH)2↓ | |
| B. | 用小苏打(NaHCO3)治疗胃酸(主要成分是盐酸)过多:CO32-+H+═CO2↑+H2O | |
| C. | 将少量二氧化碳气体通入澄清石灰水中:2OH-+CO2═CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
13.仅用一种试剂便可以将苯、苯酚、四氯化碳、乙醛等4种无色液体进行鉴别,这种试剂是( )
| A. | 银氨溶液 | B. | 新制的氢氧化铜 | C. | 溴水 | D. | 氢氧化钠溶液 |
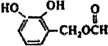 .
.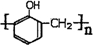 .
.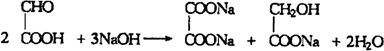 .
. 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: