题目内容
15.已知100kPa、298.15K时氢氟酸的电离过程HF(aq)═H+(aq)+F-(aq)△H=-12.5kJ•mol-1,△S=-102.5J•mol-1•K-1,试判断该过程的自发性.分析 反应能否自发进行,决定于△H-T△S的大小,△H-T△S<0时反应能自发进行,△H-T△S>0时,反应不能自发进行,据此分析.
解答 解:本题中△H-T△S=-12.5KJ/mol-[-102.5KJ/(mol•K)×298.15K]=30547.875>0,则该过程为非自发过程,答:该过程为非自发过程.
点评 本题考查反应能否自发进行的条件,△H-T△S的大小决定反应能否自发进行,题目难度不大.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
13.下列化学用语表示正确的是( )
| A. | 氧的原子结构示意图: | B. | 甲烷的比例模型: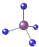 | ||
| C. | 硫化钾的电子式: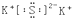 | D. | CO2的结构式:O-C-O |
6.0.1L某溶液含有0.1mol KCl和0.1mol CaCl2,此溶液中Cl-的物质的量浓度是( )
| A. | 3mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.1mol•L-1 |
20.工业上用5.1t氨制取硝酸,理论上能生成63%在硝酸( )
| A. | 10t | B. | 11.9t | C. | 20t | D. | 30t |
7.向NaBr,NaI的混合液中通入足量的氯气,加热,再将溶液蒸干灼烧,最后得到残留物( )
| A. | NaCl | B. | NaBr、NaI、NaCl | C. | NaBr、NaI | D. | NaCl、I2 |
4.欲观察氢气燃烧的颜色,燃烧管的材料最好采用( )
| A. | 普通玻璃 | B. | 含钾玻璃 | C. | 铜管 | D. | 石英玻璃 |
5.W、X、Y、Z是元素周期表中前四周期的四种元素,它们的原子序数依次递增.请结合下表中的信息,回答下列问题:
(1)W的第一电离能大于其同周期相邻的元素的原因是氮元素的原子核外2p能级的电子排布处于半满状态比较稳定;Z3+的M层电子数为13.
(2)W、X、Y三种元素的简单离子半径的大小关系是C1->N3->Al3+ (请用离子符号表示).
(3)Y的气态氢化物的沸点是同族元素形成的气态氢化物中最低 (填“高”或“低”);XW晶体与金刚石类似,与同一个W原子相连的X原子构成的空间构型为正四面体形.
(4)在25℃、101 kPa下,Z的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出Q kJ的热量,则Z单质燃烧的热化学方程式为3Fe(s)+2O2(g)═Fe3O4(s)△H=-8QkJ•mol-1 .
(5)在一定条件下,利用W的氢化物可使空气污染物之一的WO2转化为参与大气循环的物质.请写出一个符合上述条件的反应方程:6NO2+8NH3=7N2+12H2O.
| W | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| X | 常见的金属,在周期表中的周期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 其原子质量数为56,中子数为30的核素 |
(2)W、X、Y三种元素的简单离子半径的大小关系是C1->N3->Al3+ (请用离子符号表示).
(3)Y的气态氢化物的沸点是同族元素形成的气态氢化物中最低 (填“高”或“低”);XW晶体与金刚石类似,与同一个W原子相连的X原子构成的空间构型为正四面体形.
(4)在25℃、101 kPa下,Z的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出Q kJ的热量,则Z单质燃烧的热化学方程式为3Fe(s)+2O2(g)═Fe3O4(s)△H=-8QkJ•mol-1 .
(5)在一定条件下,利用W的氢化物可使空气污染物之一的WO2转化为参与大气循环的物质.请写出一个符合上述条件的反应方程:6NO2+8NH3=7N2+12H2O.
