题目内容
【题目】NA 表示阿伏加德罗常数的值。下列关于1 L 0. lmo/L FeCl3溶液的说法中正确的是
A.加热煮沸至溶液呈红褐色时,得到0. 1 NA Fe( OH)3 胶体粒子
B.室温下,加水稀释后,溶液中 c(OH- ) 减小
C.加入0. 3 mol KSCN 溶液,生成0. 1 mol Fe(SCN)3 的红色物质
D.加入0. 15 mol NaOH 固体后 ,3c( Fe3 + ) +c(H+) =c(Na+) +c(OH-)
【答案】D
【解析】
A.加热煮沸时,Fe3+不可能完全水解,即便完全水解,得到Fe( OH)3 胶体粒子也应小于0. 1 NA,因为Fe( OH)3 胶体粒子由许许多多个Fe( OH)3 分子聚集而成,A不正确;
B.室温下,加水稀释,虽然Fe3+的水解程度增大,但溶液中c(H+)减小,c(OH- )增大,B不正确;
C.Fe3+与SCN-生成Fe(SCN)3的反应为可逆反应,所以加入0. 3 mol KSCN 溶液,生成Fe(SCN)3的物质的量应小于0.1mol,C不正确;
D.加入0. 15 mol NaOH 固体后,溶液中剩余Fe3+为0.05mol,Na+为0.15mol,在溶液中存在下列平衡:Fe 3++3H2O![]() Fe(OH)3+3H+[设参加反应的n(Fe3+)=x,则生成n(H+)=3x]、H2O
Fe(OH)3+3H+[设参加反应的n(Fe3+)=x,则生成n(H+)=3x]、H2O![]() H++OH-[设发生电离的n(H2O)=y,则生成n(H+)=n(OH-)=y],3n( Fe3 + ) +n(H+)=[3×(0.05-x)+3x+y]mol=(0.15+y)mol=n(Na+) +n(OH-),所以3c( Fe3 + ) +c(H+) =c(Na+) +c(OH-),D正确;
H++OH-[设发生电离的n(H2O)=y,则生成n(H+)=n(OH-)=y],3n( Fe3 + ) +n(H+)=[3×(0.05-x)+3x+y]mol=(0.15+y)mol=n(Na+) +n(OH-),所以3c( Fe3 + ) +c(H+) =c(Na+) +c(OH-),D正确;
故选D。

 小题狂做系列答案
小题狂做系列答案【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
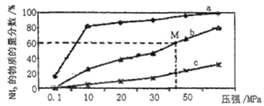
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
k=__________________________。
(3)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:
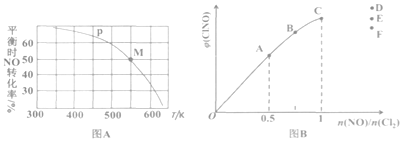
①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在P压强条件下进行,则M点的分压平衡常数KP=________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_______点。