题目内容
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为![]() 、
、![]() 和
和![]() 。
。
(1)![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置____。
在元素周期表中的位置____。
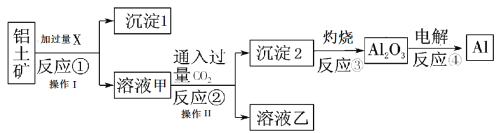
其中铜、硒、碲的主要回收流程如图:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。
①写出![]() 硫酸化焙烧的化学方程式____。
硫酸化焙烧的化学方程式____。
②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因___。
③滤液2经过____、_____、过滤、洗涤、干燥可以得到硫酸铜晶体。
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是____(填序号)。

a.455℃ b.462℃ c.475℃ d.515℃
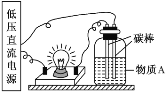
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了
浓度的增加,促进了![]() 的沉积。写出
的沉积。写出![]() 的沉积的电极反应式为____。
的沉积的电极反应式为____。

【答案】第四周期VIA族 Cu2Se+6H2SO4![]() 2CuSO4+SeO2+4SO2↑+6H2O 由于存在平衡:Ag2SO4(s)
2CuSO4+SeO2+4SO2↑+6H2O 由于存在平衡:Ag2SO4(s) ![]() 2Ag+(aq)+SO42-(aq),加入氯化钠固体后,
2Ag+(aq)+SO42-(aq),加入氯化钠固体后,![]() 与
与![]() 反应生成成更难溶的氯化银,使得
反应生成成更难溶的氯化银,使得![]() 降低,进而减少了硫酸银中的银进入滤液 加热浓缩 冷却结晶 c
降低,进而减少了硫酸银中的银进入滤液 加热浓缩 冷却结晶 c ![]()
【解析】
(1)34Se,质子数为34,推出位于元素周期表中第四周期VIA族;
答案是第四周期VIA族;
(2)①根据流程,“硫酸焙烧”Cu2Se转化成CuSO4、SeO2,SeO2为氧化产物,硫酸被还原成SO2,即反应方程式为Cu2Se+6H2SO4![]() 2CuSO4+SeO2+4SO2↑+6H2O;
2CuSO4+SeO2+4SO2↑+6H2O;
答案Cu2Se+6H2SO4![]() 2CuSO4+SeO2+4SO2↑+6H2O;
2CuSO4+SeO2+4SO2↑+6H2O;
②水浸固体中含有Ag2SO4,存在溶解平衡:Ag2SO4(s) ![]() 2Ag+(aq)+SO42-(aq),Ag2SO4微溶于水,AgCl难溶于水,因此加入NaCl,Ag+和Cl-结合成更难溶的AgCl,使得c(Ag+)降低,进而减少了硫酸银中银进入滤液中;
2Ag+(aq)+SO42-(aq),Ag2SO4微溶于水,AgCl难溶于水,因此加入NaCl,Ag+和Cl-结合成更难溶的AgCl,使得c(Ag+)降低,进而减少了硫酸银中银进入滤液中;
答案为溶解平衡:Ag2SO4(s) ![]() 2Ag+(aq)+SO42-(aq),加入NaCl,Ag+和Cl-结合成更难溶的AgCl,使得c(Ag+)降低,从而减少了硫酸银中的银进入滤液中;
2Ag+(aq)+SO42-(aq),加入NaCl,Ag+和Cl-结合成更难溶的AgCl,使得c(Ag+)降低,从而减少了硫酸银中的银进入滤液中;
③因为是得到硫酸铜晶体,因此滤液2经过加热浓缩、冷却结晶、过滤、洗涤、干燥可以得到硫酸铜晶体;
答案加热浓缩;冷却结晶;
(3)根据图象,在略低于480℃挥发物中硒的含量最高,因此最佳温度为475℃,故c正确;
答案选c;
(4)由电解原理可知,TeO32-应在阴极上发生还原反应生成Te,其电极反应式为TeO32-+4e-+3H2O=Te+6OH-;
答案为TeO32-+4e-+3H2O=Te+6OH-。

【题目】化学在能源开发与利用中起着十分关键的作用。能源分为一级能源和二级能源,将自然界中存在的能源称为一级能源,通过其它方式获得的能源称为二级能源。甲烷、氢气是重要的能源。回答下列问题:
(1)关于甲烷、氢气的说法正确的是___
A.甲烷和氢气都是一级能源 B.甲烷是一级能源,氢气是二级能源
C.甲烷和氢气都是二级能源 D.甲烷是二级能源,氢气是一级能源
(2)![]() 经催化重整可以获得合成气:
经催化重整可以获得合成气:![]()
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H |
| H—H |
|
键能/ | 413 | 745 | 436 | 1075 |
则该反应的![]() _____
_____![]() 。
。
②已知:![]()
![]()
![]()
![]()
而C(s)的燃烧热![]()
该催化重整反应的![]() ___
___![]() (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(3)氢气是氯碱工业的副产品,产生氢气的电极反应式为___。
(4)利用氢气可以合成氨,将![]() 通入NaClO的溶液中可以获得
通入NaClO的溶液中可以获得![]() 写出
写出![]() 的电子式__。该反应的化学方程式为____。
的电子式__。该反应的化学方程式为____。
(5)CO也是一种重要燃料,利用其燃烧可以设计成新型燃料电池,该电池利用熔融的碳酸盐为电解质,该燃料电池负极的电极反应式为____。
【题目】X、Y、Z、W、Q五种元素,原子序数均小于36,它们的核电荷数依次增加,且核外电子数之和为54。X的激发态原子电子排布式为![]() ,Y原子的基态原子
,Y原子的基态原子![]() 能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)基态Q原子价电子排布式为_____。
(2)X、Y、Z、Q电负性由大到小排序为___(写元素符号)
(3)X与Z形成的化合物![]() ,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
(4)W的氯化物和![]() 的氧化物中,熔点较高的是____(填化学式),原因是_____。
的氧化物中,熔点较高的是____(填化学式),原因是_____。
(5)由X、Y组成的一种微粒结构如图![]() ,请写出该微粒的化学式:_____。
,请写出该微粒的化学式:_____。
(6)图(a)是![]() 的拉维斯结构,
的拉维斯结构,![]() 以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为
以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为![]() ,则
,则![]() 的密度是_____
的密度是_____![]() (列出计算表达式)。
(列出计算表达式)。